Клинический эффект бактериальных лизатов в терапии респираторных и аллергических заболеваний
Вторичная иммунная недостаточность характеризуется обратимыми нарушениями иммунной системы, ее адаптационных механизмов и других функций, снижающих иммунный ответ. У пациентов с аллергическими заболеваниями респираторного тракта, часто и длительно болеющих детей имеют место клинические и иммунологические особенности инфекционного и аллергического процесса. Это послужило основанием для использования в лечении данной группы больных бактериальных лизатов, в частности OM-85. Бактериальные лизаты стимулируют как неспецифический, так и специфический иммунный ответ на воздействие бактериальных патогенов, антигены которых входят в состав OM-85. В статье приведен клинический случай применения OM-85 у пациентки с бронхиальной астмой.Таблица. Механизм действия бактериальных лизатов
Последние десятилетия отмечается рост заболеваний, связанных с нарушениями в системе иммунитета, торпидных к адекватной этиотропной терапии.
ВИН не только осложняет течение заболеваний, в том числе аллергических, прежде всего бронхиальной астмы, аллергодерматозов, острых токсико-аллергических реакций, но и способствует генерализации инфекции, развитию осложнений, торпидности к традиционным методам лечения, инвалидизации и увеличению летальности [1, 2]. Снижение эффективности стандартной базисной терапии и наличие клинических и лабораторных признаков ВИН с различными заболеваниями потребовали разработки и определения принципов назначения иммуномодуляторов.
Определение и характеристика иммуномодуляторов микробного происхождения
Иммуномодуляторы – лекарственные средства с иммунотропной активностью, применение которых в терапевтических дозах способствует восстановлению функции иммунной системы. Иными словами, иммуномодуляторы приводят в норму измененные показатели и не влияют на нормальные показатели [3].
В настоящее время в России зарегистрировано множество препаратов, декларируемых как иммуномодуляторы, но далеко не все из них обладают доказательной базой. Между тем к выбору препарата следует подходить с позиции именно доказательной медицины. Среди основных клинических критериев эффективности иммуномодулирующих препаратов можно выделить удлинение периода ремиссии, существенное снижение числа обострений, уменьшение потребности в антибактериальных и других химиотерапевтических препаратах, улучшение качества жизни [4].
Первыми из группы иммуномодуляторов микробного происхождения были применены бактериальные лизаты, приготовленные из различных штаммов бактерий (в частности, OM-85). Они играют роль поливалентной вакцины, увеличивая содержание специфических антител к микробам, входящим в состав препарата. О том, что клеточные органеллы, рибосомы, специализирующиеся на биосинтезе клеточных протеинов, наделены свойствами вакцины, было известно еще в 1950-е гг. [5]. Их высокий антигенный потенциал с выраженной иммуногенностью использовали при создании рибосомальных вакцин. Иммуномодулятор, полученный в результате разрушения бактериальных клеток, содержит большое число как антигенов (АГ), так и ассоциированных с микробами молекулярных паттернов (МАМП).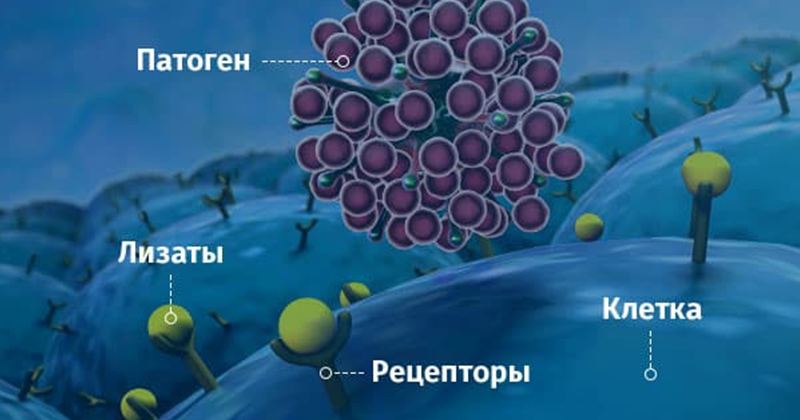
Для предотвращения и комплексного лечения инфекций дыхательных путей, полости рта и ЛОР-органов могут быть использованы лизаты бактерий, являющихся наиболее частыми возбудителями заболеваний указанных локализаций, в различных лекарственных формах (пероральной, сублингвальной, интраназальной и для рассасывания во рту) [6]. Рассматриваемую группу иммуномодуляторов можно условно разделить на препараты с преимущественно системным иммуностимулирующим действием (OM-85), основные фармакологические эффекты которых реализуются вдали от зоны первичной доставки бактериальных АГ и МАМП, и топические бактериальные лизаты, действующие главным образом в местах введения.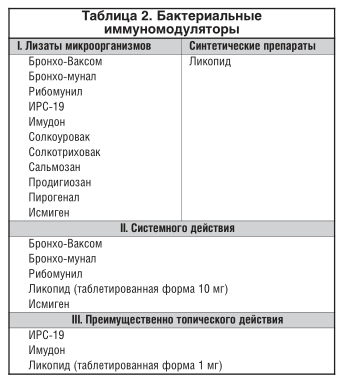
Необходимо учитывать, что повышенная восприимчивость к инфекциям развивается только под воздействием дополнительных неиммунологических факторов, например социально-гигиенических, а также при наличии хронических очагов инфекции, соматических заболеваний [2]. Причины повышенной заболеваемости неосложненными респираторными инфекциями в большинстве случаев остаются неясными, поэтому решение о назначении иммуномодулирующих препаратов должно основываться на клинических показаниях. Дисбактериозы слизистых оболочек, кожи, желудочно-кишечного тракта, бронхолегочной системы также способствуют изменению иммунологической реактивности организма, в то время как неблагоприятное эпидемиологическое окружение и плохая экология усугубляют патологический процесс, приводя к формированию повышенной чувствительности организма к вирусным и бактериальным инфекциям. Повторные инфекции становятся причинами острых и хронических синуситов, тонзиллитов, отитов, способствуют развитию хронической бронхолегочной и аллергической патологии, вторичной иммуносупрессии.
Таким образом, действие иммунотропных препаратов бактериального происхождения направлено на активацию моноцитарно-макрофагальной системы в отношении элиминации чужеродных в антигенном отношении субстанций.
ОМ-85: механизм действия и клиническая эффективность
К известным и хорошо изученным иммуномодуляторам бактериального происхождения относится препарат OM-85 – лиофилизированный лизат восьми видов бактерий, наиболее часто вызывающих инфекции дыхательных путей:
 viridans, Haemophilus influenzae, Klebsiella pneumoniae, K. ozaenea, Staphylococcus aureus, Moraxella catarrhalis [3]. Пероральный прием препарата приводит к контакту антигенов возбудителей с макрофагами, находящимися в слизистой оболочке желудочно-кишечного тракта. Запускается процесс «праймирования» лимфоцитов, заключающийся в их активации и пролиферации с последующей презентацией их лимфоцитам МАLТ-системы (мукозо-ассоциированная лимфоидная ткань) в пейеровых бляшках. Праймированные лимфоциты покидают пейерову бляшку по лимфатическим сосудам и попадают в брыжеечный лимфоузел, затем мигрируют в кровь, где происходит их дальнейшая дифференцировка. В результате появляются коммитированные клоны В-лимфоцитов, продуцирующие специфические антитела к антигенам возбудителей. Кроме того, миграция коммитированных В-лимфоцитов из пейеровых бляшек в другие лимфоидные органы (миндалины глоточного кольца, лимфоузлы бронхолегочного аппарата и урогенитального тракта) и их последующая дифференциация в плазмоциты приводят к продукции высокоаффинного секреторного иммуноглобулина (Ig) класса A и развитию эффективной местной иммунной защиты против возбудителей.
viridans, Haemophilus influenzae, Klebsiella pneumoniae, K. ozaenea, Staphylococcus aureus, Moraxella catarrhalis [3]. Пероральный прием препарата приводит к контакту антигенов возбудителей с макрофагами, находящимися в слизистой оболочке желудочно-кишечного тракта. Запускается процесс «праймирования» лимфоцитов, заключающийся в их активации и пролиферации с последующей презентацией их лимфоцитам МАLТ-системы (мукозо-ассоциированная лимфоидная ткань) в пейеровых бляшках. Праймированные лимфоциты покидают пейерову бляшку по лимфатическим сосудам и попадают в брыжеечный лимфоузел, затем мигрируют в кровь, где происходит их дальнейшая дифференцировка. В результате появляются коммитированные клоны В-лимфоцитов, продуцирующие специфические антитела к антигенам возбудителей. Кроме того, миграция коммитированных В-лимфоцитов из пейеровых бляшек в другие лимфоидные органы (миндалины глоточного кольца, лимфоузлы бронхолегочного аппарата и урогенитального тракта) и их последующая дифференциация в плазмоциты приводят к продукции высокоаффинного секреторного иммуноглобулина (Ig) класса A и развитию эффективной местной иммунной защиты против возбудителей.
 Повышение уровня IgG усиливало межклеточные взаимодействия макрофагов, натуральных киллеров (таблица). Эти сдвиги можно интерпретировать как переключение иммунного ответа с Th2-типа на Th1-тип [8].
Повышение уровня IgG усиливало межклеточные взаимодействия макрофагов, натуральных киллеров (таблица). Эти сдвиги можно интерпретировать как переключение иммунного ответа с Th2-типа на Th1-тип [8].
Включение иммуномодулирующих препаратов бактериального происхождения в комплексную терапию соматических заболеваний, протекающих в сочетании с ВИН, позволило добиться высокого клинического эффекта при разных патологиях.
Одним из перспективных направлений терапии при аллергических заболеваниях, в том числе бронхиальной астме (БА), признано применение OM-85. Одним из наиболее значимых триггеров БА являются рецидивирующие респираторные инфекции. Они способствуют не только гиперпродукции IgE и развитию гиперреактивности бронхиального дерева, но и усилению сенсибилизации организма к неинфекционным аллергенам. При этом возбудитель респираторной инфекции становится причинно-значимым аллергеном [9]. БА – наиболее распространенное хроническое заболевание у взрослых и детей. У детей раннего возраста чаще встречается вирус-индуцированный фенотип астмы [4]. Респираторные вирусы (рино-, адено-, метапневмо-, респираторно-синцитиальный, гриппа, парагриппа и др.) у детей поражают эпителий дыхательных путей. Наиболее частыми провоцирующими факторами бронхообструктивного синдрома у детей раннего возраста и обострений БА становятся вирусные инфекции [9]. Клиническая эффективность OM-85 обусловлена не только предупреждением ОРИ, нередко выступающих в качестве триггеров обострения, но и нормализацией соотношения Th1/Th2. OM-85 стимулирует синтез ИЛ-12 и ИФН-гамма и одновременно тормозит образование ИЛ-10. Это создает предпосылки для индукции Th1-типа иммунного ответа, что сопровождается угнетением продукции ИЛ-4, уменьшением синтеза IgE и хемотаксиса эозинофилов. В ряде случаев у пациентов с аллергической патологией формируются хронические очаги инфекции (хронический тонзиллит и пиелонефрит, синуситы), возникают дисбиотические изменения в составе микрофлоры кишечника.
У детей раннего возраста чаще встречается вирус-индуцированный фенотип астмы [4]. Респираторные вирусы (рино-, адено-, метапневмо-, респираторно-синцитиальный, гриппа, парагриппа и др.) у детей поражают эпителий дыхательных путей. Наиболее частыми провоцирующими факторами бронхообструктивного синдрома у детей раннего возраста и обострений БА становятся вирусные инфекции [9]. Клиническая эффективность OM-85 обусловлена не только предупреждением ОРИ, нередко выступающих в качестве триггеров обострения, но и нормализацией соотношения Th1/Th2. OM-85 стимулирует синтез ИЛ-12 и ИФН-гамма и одновременно тормозит образование ИЛ-10. Это создает предпосылки для индукции Th1-типа иммунного ответа, что сопровождается угнетением продукции ИЛ-4, уменьшением синтеза IgE и хемотаксиса эозинофилов. В ряде случаев у пациентов с аллергической патологией формируются хронические очаги инфекции (хронический тонзиллит и пиелонефрит, синуситы), возникают дисбиотические изменения в составе микрофлоры кишечника. При иммунологическом обследовании выявляются признаки ВИН при использовании рутинных методов. При углубленном лабораторном обследовании, например в гемограмме, обнаруживают снижение содержания форменных элементов периферической крови, селективный дефицит IgA и IgG2, недостаток секреторного IgA, дисиммуноглобулинемию, уменьшение абсолютного количества B-лимфоцитов, незначительное (менее чем на 20%) снижение различных параметров иммунограммы (CD3, CD4, CD16), нарушение процессов интерферонообразования и ферментных систем на уровне клетки (снижение активности миелопероксидазы и повышение активности щелочной фосфатазы), сниженный фагоцитоз, уменьшение синтеза лизоцима, функциональной активности нейтрофильных лейкоцитов, повышение уровня общего IgE [4].
При иммунологическом обследовании выявляются признаки ВИН при использовании рутинных методов. При углубленном лабораторном обследовании, например в гемограмме, обнаруживают снижение содержания форменных элементов периферической крови, селективный дефицит IgA и IgG2, недостаток секреторного IgA, дисиммуноглобулинемию, уменьшение абсолютного количества B-лимфоцитов, незначительное (менее чем на 20%) снижение различных параметров иммунограммы (CD3, CD4, CD16), нарушение процессов интерферонообразования и ферментных систем на уровне клетки (снижение активности миелопероксидазы и повышение активности щелочной фосфатазы), сниженный фагоцитоз, уменьшение синтеза лизоцима, функциональной активности нейтрофильных лейкоцитов, повышение уровня общего IgE [4].
Указанные клинические данные и результаты иммунологических исследований служат основанием для использования иммунотропных фармакологических средств в лечении пациентов с аллергическими заболеваниями. Иммунотропная активность иммуномодуляторов позволяет применять их для восстановления функций иммунной системы и обеспечения должной иммунной защиты организма.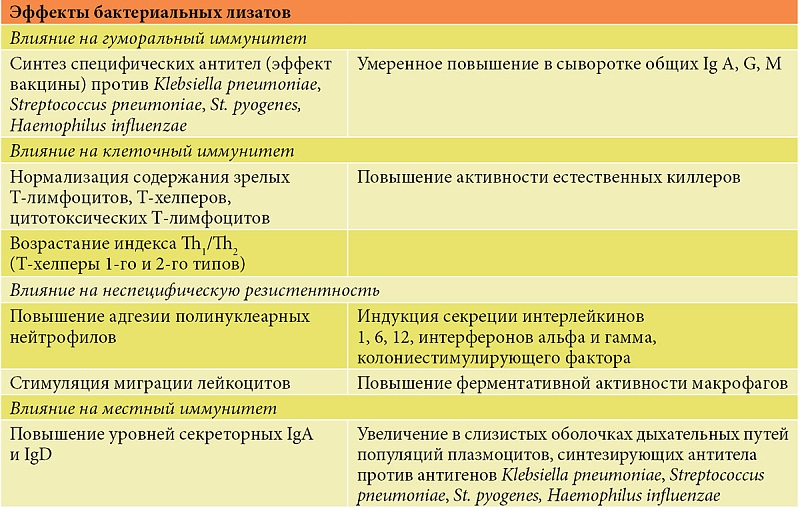 Терапия иммуномодуляторами способствует устранению острых и хронических очагов инфекции и уменьшению проявлений аллергического процесса [10]. В то же время иммуномодулирующая терапия не является этиотропной по своей направленности. По данным C.H. Razi и соавт., у детей с аллергическими заболеваниями при включении OM-85 в комплексную терапию отмечается снижение не только частоты эпизодов респираторных инфекций, но и проявлений бронхообструкции, что может быть полезным для профилактики обострений у пациентов с БА. Кроме того, OM-85 повышает функциональную активность альвеолярных макрофагов против инфекционных и опухолевых антигенов, NK-клеток, уменьшает выработку IgE. У детей с БА и частыми интеркуррентными острыми респираторными заболеваниями применение OM-85 способствует клиническому улучшению в 68% случаев. Более чем в два раза сокращается заболеваемость ОРИ с явлениями бронхообструкции в течение года. Уменьшаются количество тяжелых приступов удушья и годовая потребность ребенка в бронходилататорах.
Терапия иммуномодуляторами способствует устранению острых и хронических очагов инфекции и уменьшению проявлений аллергического процесса [10]. В то же время иммуномодулирующая терапия не является этиотропной по своей направленности. По данным C.H. Razi и соавт., у детей с аллергическими заболеваниями при включении OM-85 в комплексную терапию отмечается снижение не только частоты эпизодов респираторных инфекций, но и проявлений бронхообструкции, что может быть полезным для профилактики обострений у пациентов с БА. Кроме того, OM-85 повышает функциональную активность альвеолярных макрофагов против инфекционных и опухолевых антигенов, NK-клеток, уменьшает выработку IgE. У детей с БА и частыми интеркуррентными острыми респираторными заболеваниями применение OM-85 способствует клиническому улучшению в 68% случаев. Более чем в два раза сокращается заболеваемость ОРИ с явлениями бронхообструкции в течение года. Уменьшаются количество тяжелых приступов удушья и годовая потребность ребенка в бронходилататорах. При этом наблюдаются увеличение уровня ИФН-гамма, снижение общего IgЕ и циркулирующих иммунных комплексов в крови [11].
При этом наблюдаются увеличение уровня ИФН-гамма, снижение общего IgЕ и циркулирующих иммунных комплексов в крови [11].
Эффективность системных бактериальных лизатов в профилактике инфекций респираторного тракта
Как известно, ОРИ могут быть причиной хронических заболеваний ЛОР-органов и бронхолегочного аппарата, а также провоцировать частые и длительные обострения имеющейся патологии. Тактика ведения больных с такими заболеваниями сложна, поскольку частое и длительное применение антибиотиков формирует резистентные штаммы возбудителей инфекции дыхательных путей, что в свою очередь снижает клиническую эффективность последующей антибиотикотерапии, приводит к развитию грибковых осложнений, дисбактериоза. В последние годы для лечения и профилактики респираторных заболеваний часто используют бактериальные лизаты. Эффективность системных бактериальных иммуномодуляторов в профилактике ОРИ у часто болеющих детей доказана во многих исследованиях. Благодаря стимулированию специфического и неспецифического иммунного ответа применение OM-85 у детей с рекуррентными респираторными заболеваниями способствует снижению частоты острых респираторных заболеваний (ОРЗ), уменьшает вероятность бактериальных осложнений [8, 12]. В исследовании M.D. Sprenkle и соавт. у часто и длительно болеющих детей при назначении OM-85 в два-три раза уменьшалась частота ОРЗ, фарингитов, бронхитов [13]. По данным метаанализа, проведенного B. Del-Rio-Navarro и соавт., прием бактериальных иммуностимуляторов приводит к сокращению числа острых инфекций дыхательных путей и их осложнений у часто болеющих детей [14].
В исследовании M.D. Sprenkle и соавт. у часто и длительно болеющих детей при назначении OM-85 в два-три раза уменьшалась частота ОРЗ, фарингитов, бронхитов [13]. По данным метаанализа, проведенного B. Del-Rio-Navarro и соавт., прием бактериальных иммуностимуляторов приводит к сокращению числа острых инфекций дыхательных путей и их осложнений у часто болеющих детей [14].
Кроме того, бактериальные иммуномодуляторы используются для профилактики и лечения заболеваний верхних дыхательных путей – ангины, тонзиллита, фарингита, ларингита, синусита и отита [15]. Колонизация носоглотки микробами определяет патогенез инфекционно-воспалительных заболеваний респираторного тракта и ЛОР-органов. Чаще встречаются грамположительные бактерии (St. pneumoniae – 7–35% случаев, St. pyogenes – 5–11%) и грамотрицательные (H. influenzae – 5–20% случаев, K. pneumoniae – 5%) [5].
Анализ этиологической структуры бактериальных инфекций респираторного тракта и ЛОР-органов позволяет сделать вывод, что данные пневмотропные возбудители наиболее значимы.
В ряде исследований продемонстрировано снижение количества обострений хронического фарингита и среднего отита в два раза при использовании OM-85 [8, 12]. На фоне его применения в целях профилактики рецидивов хронического бронхита снижаются частота и тяжесть рецидивов, уменьшаются случаи госпитализации в 1,43 раза, ее продолжительность – в 1,8 раза. У детей с хроническим риносинуситом снижаются частота рецидивов и тяжесть симптомов [13]. OM-85 назначают во время ОРИ или при обострении хронических заболеваний ЛОР-органов одновременно с антибиотиками, что потенцирует действие последних. Они могут быть полезны в лечении инфекции, резистентной к антибактериальным препаратам, особенно при высевании из зева и носоглотки двух и более бактериальных возбудителей [15, 16]. Микробная контаминация дыхательных путей нередко провоцирует и поддерживает обострения хронического бронхита и хронической обструктивной болезни легких (ХОБЛ). При этом развивается бактериальное воспаление, усиливается секреция мокроты, ухудшается легочная функция. Один из функциональных и безопасных подходов к профилактике рецидивирующих инфекций дыхательных путей и обострений ХОБЛ – активация адаптивного и врожденного иммунного ответа, что может быть достигнуто при использовании бактериальных механических лизатов, например OM-85. Препарат отличается высоким профилем безопасности. O. Zagólski и соавт. [17], сравнивая воздействие бактериальных лизатов и аутовакцин на потенциально патогенные микроорганизмы носоглотки, показали, что в случае колонизации дыхательного тракта H. influenzae бактериальные лизаты более эффективны, чем аутовакцины (р
Один из функциональных и безопасных подходов к профилактике рецидивирующих инфекций дыхательных путей и обострений ХОБЛ – активация адаптивного и врожденного иммунного ответа, что может быть достигнуто при использовании бактериальных механических лизатов, например OM-85. Препарат отличается высоким профилем безопасности. O. Zagólski и соавт. [17], сравнивая воздействие бактериальных лизатов и аутовакцин на потенциально патогенные микроорганизмы носоглотки, показали, что в случае колонизации дыхательного тракта H. influenzae бактериальные лизаты более эффективны, чем аутовакцины (р
Таким образом, OM-85 можно отнести к иммуномодулирующим препаратам с доказанной эффективностью и безопасностью как у взрослых, так и у детей [20–22].
Согласно метаанализу, достоверных различий в отношении побочных эффектов между группой иммуномодуляторов микробного происхождения и группой плацебо не зафиксировано. Отмечается хорошая переносимость бактериальных лизатов [14].
OM-85 имеет простой и удобный режим дозирования, выпускается в дозах 7 и 3,5 мг. Детям с шести месяцев до 12 лет препарат назначают в капсулах по 3,5 мг, при необходимости капсулу можно открыть и ее содержимое растворить в соке или воде.
Повторные курсы иммунотропной терапии препаратами бактериального происхождения обычно проводят не чаще одного-двух раз в год, в весенне-осенний период. Эффект одного курса сохраняется в течение шести месяцев.
Клинический случай
Пациентка А. (38 лет) впервые в августе 2015 г. обратилась к специалисту по поводу эпизодических приступов удушья, приступообразного сухого кашля, заложенности носа с отделяемым желтого цвета, общей слабости, быстрой утомляемости, частых простудных заболеваний. Из анамнеза: последние 15 лет имеют место чихание, ринорея, реже кашель при контакте с домашней пылью, в период цветения растений (июнь – июль). Приступы удушья впервые отмечались пять лет назад, в период цветения. Затем в течение года участились. В 2010 г. диагностирована бронхиальная астма, атопическая форма легкого течения. Назначена терапия ингаляционными глюкокортикостероидами (будесонид 200 мкг/доза по два вдоха два раза в день), Вентолин – ситуационно. Рекомендации ЛОР-врача: мометазона фуроат 50 мкг/доза по две инсуффляции утром до одного месяца курсами. В течение последних двух лет беспокоят частые ОРИ – до пяти-шести раз в год, осложняющиеся острым синуситом, тонзиллитом или бронхитом. За последний год применялось до пяти курсов лечения антибактериальными препаратами разных групп, назначаемыми как врачом, так и самостоятельно. С конца мая 2015 г. – ежедневные приступы затрудненного дыхания, постоянная заложенность носа, потливость, кратковременная субфебрильная температура тела. Лечение получала в поликлинике по месту жительства (будесонид/формотерол 4,5/160 мкг/доза по одному вдоху два раза в день, Амоксиклав 1000 мг три раза в день перорально семь дней, ингаляции Беродуала через небулайзер, спрей в нос мометазона фуроат по схеме два месяца).
Затем в течение года участились. В 2010 г. диагностирована бронхиальная астма, атопическая форма легкого течения. Назначена терапия ингаляционными глюкокортикостероидами (будесонид 200 мкг/доза по два вдоха два раза в день), Вентолин – ситуационно. Рекомендации ЛОР-врача: мометазона фуроат 50 мкг/доза по две инсуффляции утром до одного месяца курсами. В течение последних двух лет беспокоят частые ОРИ – до пяти-шести раз в год, осложняющиеся острым синуситом, тонзиллитом или бронхитом. За последний год применялось до пяти курсов лечения антибактериальными препаратами разных групп, назначаемыми как врачом, так и самостоятельно. С конца мая 2015 г. – ежедневные приступы затрудненного дыхания, постоянная заложенность носа, потливость, кратковременная субфебрильная температура тела. Лечение получала в поликлинике по месту жительства (будесонид/формотерол 4,5/160 мкг/доза по одному вдоху два раза в день, Амоксиклав 1000 мг три раза в день перорально семь дней, ингаляции Беродуала через небулайзер, спрей в нос мометазона фуроат по схеме два месяца). На фоне терапии: приступы удушья редкие (до одного раза в две недели, купируемые в основном самостоятельно), сохранялись сухой кашель утром, заложенность носа, быстрая утомляемость, потливость.
На фоне терапии: приступы удушья редкие (до одного раза в две недели, купируемые в основном самостоятельно), сохранялись сухой кашель утром, заложенность носа, быстрая утомляемость, потливость.
При осмотре: состояние удовлетворительное. Кожа и слизистые оболочки чистые, нормальной окраски. Отеков нет. Рост – 172 см, вес – 81 кг. Носовое дыхание затруднено с обеих сторон. Дыхание жесткое, выслушиваются хрипы на форсированном выдохе. Частота дыхательных движений (ЧДД) – 16 в минуту. Тоны сердца: ясные, ритм правильный. Частота сердечных сокращений (ЧСС) – 68 в минуту. Артериальное давление (АД) – 95/75 мм рт. ст. Язык влажный, обложен белым налетом. Живот в акте дыхания участвует, при пальпации мягкий, безболезненный. Печень не увеличена, область пальпации безболезненная. Стул однократный, оформленный. Симптом «поколачивания» отрицательный. Мочеиспускание свободное, безболезненное.
Результаты обследования от 14 августа 2015 г.
Общий анализ крови: гемоглобин 144,0 г/л (норма 120–140), гематокрит 43,2% (36–42), эритроциты 4,49 × 1012/л (3,90–4,70), средний объем эритроцита 96,2 фл (80–100), средний уровень гемоглобина 32,1 пг (27–31), средняя концентрация гемоглобина в эритроците 333,0 г/л (320–380), коэффициент анизотропии эритроцитов 13,0% (0–14,5), цветовой показатель (ЦП) 0,96 Ед (0,85–1,05), тромбоциты 185,0 × 10⁹/л (180–320), средний объем тромбоцита 8,2 фл (7,6–10,8), лейкоциты 3,40 × 10⁹/л (4–9), лимфоциты 18,4% (19–37), нейтрофилы 5,1 × 10⁹/л (2,00–7,5), моноциты 0,70 × 10⁹/л (0,3–1,1), эозинофилы 11% (1,00–5,00), базофилы 0,08 × 109/л (0,08), скорость оседания эритроцитов (СОЭ) 15 мм/ч (2–15).
Общий анализ мочи: цвет желтый (янтарно-желтый/соломенно-желтый), прозрачная, рН слабо-кислая 6,5 (5,0–7,0), плотность 1018 г/л (1004–1030), белок 0,1 г/л, глюкоза 0 ммоль/л (0–1,7), кетоны – нет (отрицательно), эритроциты 0 кл/мкл (0–26), эпителий плоский 3 кл/мкл (0–39), эпителий переходный 0 кл/мкл (0–6), цилиндры 0 кл/мкл (0–2), цилиндры патологические 0 кл/мкл (0–1), лейкоциты 1 кл/мкл (0–35), слизь 26 кл/мкл (0–79), дрожжеподобные клетки 0 кл/мкл (0–0,02), бактерии 0 кл/мкл (0–60), кристаллы 0 кл/мкл (0–3).
Биохимический анализ крови: глюкоза 5,36 ммоль/л (4,10–6,10), общий белок 76,3 г/л (66–83), билирубин общий 18,6 мкмоль/л (5–21), аспартатаминотрансфераза 20,0 Ед/л (0–38), аланинаминотрансфераза 16,4 Ед/л (0–38).
Иммунологические показатели крови: IgE общий 32,5 МЕ/мл (0,0–130,0), IgA 83,5 мг/дл (70–350), IgM 104,6 мг/дл (50–250), IgG 876 мг/дл (750–1800). CD3+ 62,9% (55–88), CD3+CD8+ 31% (19–37), иммунорегуляторный индекс CD4/CD8+ 1,3 (1–2,5), CD19+ 7,4% (5–19), ИФН-гамма 8 Ед/мл, НСТ (нитросиний тетразолий)-тест 6% (6–12).
Электрокардиограмма: ритм синусовый с ЧСС 82 в минуту. Электрическая ось сердца (ЭОС) – вертикальное направление.
Спирометрия (с пробой сальбутамолом 200 мкг): жизненная емкость легких (ЖЕЛ) 92,7%, объем форсированного выдоха за первую секунду (ОФВ1) 89,6%, индекс Тиффно 89,0%, МОС25 (мгновенная объемная скорость после выдоха) 84,6%, МОС50 87,3%, МОС75 85,1%. После ингаляции сальбутамола: ЖЕЛ 95,7%, ОФВ1 90,6%, индекс Тиффно 89,4%, МОС25 87,4%, МОС50 90,3%, МОС75 89,2%.
Рентгенография придаточных пазух носа: утолщение стенок носовых пазух. Проведены кожные скарификационные тесты с основными ингаляционными аллергенами: тест-контроль отрицательный, гистамин 8 × 8 мм, домашняя пыль 12 × 14 мм, библиотечная пыль 23 × 13 мм, Dermatophagoides pteronyssinus 14 × 13 мм, перо подушки 10 × 11 мм, шерсть кошки 3 × 4 мм, смесь деревьев 2 х 1 мм, смесь злаковых трав 15 × 14 мм, смесь сорных трав 2 × 2 мм.
Пациентке выставлен диагноз: бронхиальная астма, атопическая форма, персистирующее течение средней степени, контролируемая. Назначена терапия: будесонид/формотерол 4,5/160 мкг/доза по одному вдоху два раза в сутки, мометазона фуроат по две инсуффляции в каждый носовой ход один раз в сутки три месяца, OM-85 7 мг по стандартной схеме с 17 по 26 августа, с 16 по 25 сентября, с 16 по 26 октября 2015 г. по одной таблетке в сутки. Через пять месяцев курс ОМ-85 7 мг по указанной схеме повторен (с 21 по 30 марта, с 20 по 29 апреля, с 20 по 29 мая 2016 г.).
Повторные осмотр и обследование через девять месяцев – 31 мая 2016 г. Значительное улучшение состояния пациентки (в период пыления растений редкие симптомы БА, сохранялись приступообразный кашель и заложенность носа в июне – июле, за период наблюдения два эпизода ОРИ, слабости нет, эпизодическая утомляемость).
Общий анализ крови: гемоглобин 140 г/л (120–140), гематокрит 42,0% (36–42), эритроциты 4,31 × 1012/л (3,9–4,7), средний объем эритроцита 97,0 фл (80–100), среднее содержание гемоглобина 32,0 пг (27–31), средняя концентрация гемоглобина в эритроците 344,0 г/л (300–380), коэффициент анизотропии эритроцитов 12,3% (0–14,5), ЦП 0,97 Ед (0,85–1,05), тромбоциты 193 × 10⁹/л (180–320), средний объем тромбоцита 9,6 фл (7,4–10,4), лейкоциты 4,1 × 10⁹/л (4–9), лимфоциты 1,9 × 10⁹/л (1,2–3,0), лимфоциты 21,4% (19–37), моноциты 3,50% (3–11), нейтрофилы 7,1 × 10⁹/л (2,00–7,5), моноциты 0,60 × 10⁹/л (0,3–1,1), эозинофилы 8% (1,00–5,00), СОЭ 8 мм/ч (2–15).
Общий анализ мочи: показатели в пределах нормы.
Биохимический анализ крови: показатели в пределах нормы.
Иммунологические показатели: IgE общий 438 МЕ/мл (0,0–130,0), IgA 114,9 мг/дл (70–350), IgM 102,6 мг/дл (50–250), IgG 921 мг/дл (750–1800). CD3+ 61,4% (55–88), CD3+CD8+ 28% (19–37), иммунорегуляторный индекс CD4/CD8+ 1,5 (1–2,5), CD19+ 7,9% (5–19), ИФН-гамма 16 Ед/мл, НСТ-тест 7 (6–12).
Спирометрия (с пробой сальбутамолом 200 мкг): ЖЕЛ 91,5%, ОФВ1 90,3%, индекс Тиффно 89,7%, МОС25 85,2%, МОС50 86,8%, МОС75 87,1%. После ингаляции сальбутамола: ЖЕЛ 93,0%, ОФВ1 91,1%, индекс Тиффно 88,4%, МОС25 87,4%, МОС50 91,3%, МОС75 90,2%.
Диагноз тот же, базисное лечение БА, ринита продолжено. В декабре 2016 г. начат первый курс аллергенспецифической иммунотерапии (АСИТ) с пыльцой злаковых трав.
Как видим, на фоне лечения OM-85 (два курса в течение года) улучшилось общее самочувствие (уменьшились слабость, утомляемость, частота симптомов БА, восстановилась физическая работоспособность пациентки). Эффективность препарата проявилась и в снижении частоты и длительности течения острых респираторных инфекций. Через девять месяцев в контрольных анализах крови в динамике регистрировалось незначительное снижение уровней IgM, IgE при повышении уровней IgА и IgG в сыворотке, повышение уровня ИФН-гамма. Кроме того, у пациентки отмечалось снижение численности клеточных популяций с маркерами CD3, являющихся показателями активности Th2-иммунного ответа. С учетом положительной динамики течения заболевания и достижения контроля БА пациентке начат первый курс АСИТ.
Эффективность препарата проявилась и в снижении частоты и длительности течения острых респираторных инфекций. Через девять месяцев в контрольных анализах крови в динамике регистрировалось незначительное снижение уровней IgM, IgE при повышении уровней IgА и IgG в сыворотке, повышение уровня ИФН-гамма. Кроме того, у пациентки отмечалось снижение численности клеточных популяций с маркерами CD3, являющихся показателями активности Th2-иммунного ответа. С учетом положительной динамики течения заболевания и достижения контроля БА пациентке начат первый курс АСИТ.
Заключение
Бактериальные лизаты – иммуномодуляторы с доказанной эффективностью. Их применение обоснованно даже при аллергических заболеваниях, когда целями иммунотерапии являются снижение выраженности воспалительной реакции и улучшение клинической картины основного заболевания, а при наличии хронического очага инфекции – его ликвидация.
Включение иммуномодуляторов микробного происхождения в комплексную терапию респираторных инфекций позволяет обеспечить локализацию очагов инфекции, снизить риск развития осложнений, а также потребность в антибактериальных и противовоспалительных препаратах.
SPLAT Innova — зубные пасты с гидроксиапатитом,
Многие из вас знакомы с разработкой SPLAT, системой Sp White System, которая сейчас есть во многих пастах SPLAT. В 2018 году мы разработали её более современный вариант — Sp White System BIO, которая будет использоваться в новых продуктах. Уже сейчас усовершенствованную систему можно найти в новинках — пастах Sensitive Ultra и Sensitive White.
Sp White System BIO – это комплекс компонентов для безопасного очищения эмали, заботе о здоровье ротовой полости, укрепления эмали. Рассмотрим поподробнее компоненты, которые в него входят.
Самый интересный и инновационный компонент – лизат бифидобактерий. Бифидобактерии уже давно применяются в качестве иммуномодулирующих компонентов, и лекарства, содержащие их, у всех на слуху. Но использование полезных бактерий в средствах для ухода за полостью рта – это настоящая инновация, причем впервые в состав пасты включен лизат сразу трех пробиотических микроорганизмов.
Дело в том, что живые бактерии использовать в пасте нельзя – они все равно погибнут. Поэтому мы включили в состав новых средств бактериальные лизаты – это частицы бактерий, разрушенных ультразвуком, но сохраняющие полезные свойства этих бактерий. Кроме того, в отличие от живых пробиотиков, лизаты не синтезируют кислоту, а значит не создают кариесогенную среду в полости рта.
Действие бактериальных лизатов кратко можно описать так: они «настраивают» работу иммунных клеток таким образом, чтобы те «думали», что во рту преобладает нормальная флора. При этом снижается воспалительная активность этих клеток, что препятствует развитию гингивита и пародонтита.
Помимо этого, в лизатах содержатся бактериоцины – молекулы, с помощью которых бифидобактерии подавляют только патогенную микрофлору полости рта, т.е. работают как натуральный безопасный антибиотик избирательного действия.
Отдельным преимуществом бактериальных лизатов является то, что в отличие от живых пробиотиков, они неспособны переносить гены устойчивости к антибиотикам.
Другой инновационный компонент системы – аморфный цинкозамещенный гидроксиапатит. Гидроксиапатит часто используется в средствах для ухода за зубами, поскольку это минерал, из которого состоят кости и зубы. Он способен глубоко проникать в микротрещины на эмали, закупоривая их, и тем самым восстанавливать зуб, подобно пломбе. Но в отличие от обычного гидроксиапатита, в основе которого только кальций, в зубных пастах SPLAT используется наногидроксиапатит, в который, помимо кальция, добавлен магний и цинк. Благодаря этому система Sp White System BIO, не только восстанавливает структуру эмали, но также выполняет противовоспалительную и ранозаживляющую функции.
Силика, или диоксид кремния, – главная составляющая песка, она используется в большинстве зубных паст во всем мире в качестве абразивного компонента. Однако в наших зубных пастах используется не песок, а округлые частицы силики Sorbosil размером в несколько микрометров. Они эффективно удаляют налет, не травмируя эмаль, а за счет своего полирующего действия придают зубам гладкость и блеск.
Бромелаин – фермент ананаса, который расщепляет налет, позволяя легко и безопасно очистить эмаль.
PVP образует пленку на поверхности очищенного зуба и препятствует прикреплению окрашивающих веществ и вредных бактерий.
Таким образом, система Sp White System BIO комплексно очищает и осветляет эмаль зубов, защищает от кариеса и гингивита, а также нормализует баланс микробиоты полости рта. Эта система – не единственная составляющая зубных паст SPLAT. Все наши пасты – комплексного действия, каждая содержит до 20 активных компонентов, т.е. помимо основной своей функции – очищения – они решают и другие задачи полости рта: укрепляют, ухаживают за мягкими тканями, поддерживают местный иммунитет полости рта и т.д.»
СМЕСЬ ЛИЗАТОВ БАКТЕРИЙ ДЛЯ ТОПИЧЕСКОГО ПРИМЕНЕНИЯ В ПРОФИЛАКТИКЕ И ЛЕЧЕНИИ ХРОНИЧЕСКОГО ТОНЗИЛЛИТА У ДЕТЕЙ | Гаращенко
1. Гаращенко Т.И. Тонзиллярная проблема в педиатрии. Российская ринология. 1999; 1: 68–71.
Гаращенко Т.И. Тонзиллярная проблема в педиатрии. Российская ринология. 1999; 1: 68–71.
2. Маккаев Х.М. Распространенность, особенности клинических проявлений и осложнений хронических заболеваний лимфоидного кольца у детей. Российский вестник перинатологии и педиатрии. 2002; 1: 28–32.
3. Антонив В.Ф., Перекрест А.И., Короткова Т.В. Некоторые аспекты тонзиллярной болезни в настоящее время. Вестник оториноларингологии. 1995; 6: 43–45.
4. Солдатов И.Б. Проблема тонзиллярной патологии и пути ее разрешения. Вестник АМН. 1974; 10: 61–67.
5. Альбицкий В.Ю., Баранов А.А. Часто болеющие дети. Нижний Новгород: НГМА. 2003. 179 с.
6. Glesby M., Pyeritz R. Association of mitral valve prolapsed and systemic abnormalities of connective tissue. A phenotypic continuum. JAMA. 1989; 262: 523–528.
Glesby M., Pyeritz R. Association of mitral valve prolapsed and systemic abnormalities of connective tissue. A phenotypic continuum. JAMA. 1989; 262: 523–528.
7. Kivirikko K. Collagens and their abnormalities in a wide spectrum of diseases. Ann. Med. 1993; 25: 113–126.
8. Гаращенко Т.И., Козарезова Т.И. Состояние гемокоагуляции и фибринолитических свойств крови при хроническом тонзиллите у больных геморрагическим васкулитом. Журнал ушных, носовых, горловых болезней. 1981; 4: 50–53.
9. Китайгородский А.П. О положительном эффекте аденотонзиллэктомии у детей, больных хроническим тонзиллитом, аденоидитом, сахарным диабетом. Вестник оториноларингологии. 1984; 3: 34–38.
10. Власова В. В. Клинико-иммунологические аспекты хронического тонзиллита при алиментарном ожирении. Новости оториноларингологии. 1998; 1: 61–61.
В. Клинико-иммунологические аспекты хронического тонзиллита при алиментарном ожирении. Новости оториноларингологии. 1998; 1: 61–61.
11. Быкова В.П. Морфофункциональная организация небных миндалин как лимфоэпителиального органа. Вестник оториноларингологии. 1998; 1: 41–45.
12. Быкова В.П. Современный аспект проблемы тонзиллярной болезни. Архив патологии. 1996; 3: 23–29.
13. Быкова В.П., Иванов А.А., Пакина В.Р. Морфофункциональная характеристика небной и глоточной миндалин у детей с хроническим тонзиллитом. Архив патологии. 1996; 6: 16–21.
14. Brandzaeg P. The B-development in tonsillar lymphoid follicles. Acta Otolaryngol. (Stockh.) 1996; 523: 55–56.
15. Zhou M., Zhou W., Yin H. Immunohistological observation of tonsillae in IgA nephropathy. Lin Chuang Er Di Yan Hou Ke Za Zhi. 2000; 14 (12): 536–537.
Zhou M., Zhou W., Yin H. Immunohistological observation of tonsillae in IgA nephropathy. Lin Chuang Er Di Yan Hou Ke Za Zhi. 2000; 14 (12): 536–537.
16. Заболотный Д.И., Мельников О.Ф., Кищук В.В. Исследование роли небных миндалин в формировании местного гуморального иммунитета в слизистой оболочке носа. Журнал ушных, носовых, горловых болезней. 1998; 5: 5–8.
17. Мельников О.Ф., Тимэн Г.Э., Хоцяновский К.А. Исследование состояния небных миндалин в условиях экспериментальной тонзиллотомии. Журнал ушных, носовых, горловых болезней. 1999; 4: 15–18.
18. Гаращенко Т.И., Ильенко Л.И., Гаращенко М.В. и др. Профилактическое применение Имудона у часто и длительно болеющих школьников. Вопросы современной педиатрии. 2002; 1 (5): 27–30.
19. Гаращенко Т.И., Богомильский М.Р., Маркова Т.П. Бактериальные иммунокорректоры в профилактике заболеваний верхних дыхательных путей и уха и часто болеющих детей. Consilium medicum (Педиатрия). 2002; 1: 7–13.
Гаращенко Т.И., Богомильский М.Р., Маркова Т.П. Бактериальные иммунокорректоры в профилактике заболеваний верхних дыхательных путей и уха и часто болеющих детей. Consilium medicum (Педиатрия). 2002; 1: 7–13.
20. Udovicki J., Radic S., Milankov O. Bacterial study in patients with chronic disease of the palatine tonsils. Med. Pregl. 1995; 48 (3-4): 103–107.
21. Маркова Т.П., Чувиров Д.Г. Длительно и часто болеющие дети. РМЖ. 2002; 10 (3): 125–127.
22. Маркова Т.П., Чувиров Д.Г. Клинико-иммунологическое обоснование применения Имудона у длительно и часто болеющих детей. Детский доктор. 2001; 7: 23–26.
23. Маркова Т.П., Чувиров Д.Г. Применение топических иммуномодуляторов в группе длительно и часто болеющих детей. В кн.: Иммунокоррекция в педиатрии. М. 2001. С. 91–98.
В кн.: Иммунокоррекция в педиатрии. М. 2001. С. 91–98.
24. Ying M. Immunological basis of indication for tonsillectomy and adenoidectomy. Acta Otolaryngol. (Stockh.). 1988; 454: 278–285.
25. Пальчун В.Т., Полякова Т.С., Романова О.Н. Лечебно-диагностические подходы к проблеме хронического тонзиллита. Вестник оториноларингологии. 2001; 1: 4–7.
Иммунитет от респираторных инфекций
Дата публикации: 30.03.2020
Всемирная Организация здравоохранения трактует респираторные болезни как болезни, поражающие дыхательные пути, включая носовые ходы, бронхи и легкие. Инфекции могут повлиять на любую часть дыхательной системы. Они варьируются от острых инфекций, таких как пневмония и бронхит, до хронических состояний, таких как астма и хроническая обструктивная болезнь легких.
Атака на наш организм чаще начинается через слизистую оболочку дыхательных путей (96-97%).
Лимфаденоидное глоточное кольцо или миндалины – наиболее крупные скопления лимфоидной ткани — первые и главные защитники на пути бактерий, относятся к периферическим органам иммунитета.
Возникает вопрос, для чего необходимо «заводить» иммунную систему раньше, чем в организм попадет инфекция?
В идеале иммунная система должна реагировать на инфекцию моментально, но при ослабленном иммунитете ответная реакция может «запаздывать», что дает возможность микроорганизмам быстро проникать в ткани и органы.
И в этом случае, если иммунитет не справляется с инфекцией самостоятельно ее надо натренировать таким образом, чтоб она предотвратила атаку патогена или воспроизвела иммунный ответ против внедрившегося патогена.
Как влияет на иммунную систему прием бактериальных лизатов?
Любая бактериальная клетка имеет клеточную оболочку. Химическое или механическое разрушение клеточной оболочки вызывает гибель микроорганизма. Сам процесс разрушения клеточной оболочки называется лизисом. Лизаты – это продукт лизиса бактериальных клеток.
Сам процесс разрушения клеточной оболочки называется лизисом. Лизаты – это продукт лизиса бактериальных клеток.
Бактериальные лизаты — это таблетки для сублингвального (подъязычного) рассасывания, что обеспечивает непосредственный контакт антигенов с иммунными клетками миндалин. Бактериальные лизаты усиливают фагоцитоз и уничтожение бактерий в горле, стимулируя выработку противовоспалительных цитокинов, эти вещества необходимы для формирования клеточного иммунитета. А это, в свою очередь, повышает выработку антител. В месте рассасывания резко возрастает содержание иммунокомпетентных клеток – это и создает эффект защиты.
С помощью лизатов бактерий иммунная система к моменту атаки микроорганизмов уже находится в тонусе и встречает их «во все оружие». Поэтому лизаты бактерий здесь играют двойную роль: с одной стороны, выступают в качестве защитной профилактической меры, стимулируя защитные силы организма, с другой — могут быть использованы в острый период как эффективное средство лечения. Лизаты бактерий нужно аккуратно принимать в период острых заболеваний. Они повышают противовоспалительную активность и рассчитаны на то, чтобы при вирусной инфекции не развивались бактериальные осложнения.
Лизаты бактерий нужно аккуратно принимать в период острых заболеваний. Они повышают противовоспалительную активность и рассчитаны на то, чтобы при вирусной инфекции не развивались бактериальные осложнения.
Что нужно знать о микробиоте и косметике с бактериями
Еще одна ниша бьюти-средств, стремительно развивающаяся с прошлого года, — косметика с бактериями, которая работает с микробиотой кожи. По данным Cosmetics Business, так называемый микробиом-уход входит в пять самых главных трендов 2018 года. Более 100 лет назад И.И. Мечников выдвинул теорию, что бактерии молочной кислоты способствуют улучшению здоровья и долголетию. За исследование их полезных свойств он был удостоен Нобелевской премии. В 2016 году мировой спрос на пробиотические культуры для средств для увлажнения кожи лица составил 8,6 тысячи тонн, а к 2021 году он достигнет 10 400 тонн.
Перед тем как начать говорить о пробиотиках, нужно понять, что такое микробиота. Микробиота — это совокупность всех микроорганизмов, которые существуют в симбиозе с человеческим организмом. Они живут на всех наших слизистых оболочках, на коже, и, естественно, в желудочно-кишечном тракте.
Они живут на всех наших слизистых оболочках, на коже, и, естественно, в желудочно-кишечном тракте.
«В первую очередь от нашего симбиоза зависит формирование системы иммунитета. Ребенок рождается практически стерильный. И, как только он появляется на свет, все поверхности его тела и слизистые оболочки начинают контактировать с внешним миром. Соответственно, в первые дни жизни идет активное заселение микробиотой организма нового человека. И этот процесс, если он идет физиологически правильно, в дальнейшем определяет работу иммунной системы человека. Контакт с множеством микробных антигенов „знакомит“ иммунную систему ребенка с ними, обеспечивая выработку защитных антител и формирование иммунной памяти в распознавании, кто свой, а кто чужой», — объясняет Анна Каршиева, кандидат медицинских наук, врач-гастроэнтеролог и гепатолог медицинского центра «Атлас».
«В целом в организме человека (в зависимости от его веса) содержится от двух до трех килограммов бактерий, и это только те бактерии, которые и обеспечивают нормальное функционирование пищеварительной системы, покровных тканей и прочего», — говорит Елена Елисеева, врач-дерматолог, медицинский эксперт марки Vichy.
В состав микробиоты кожи входят различные бактерии, грибки, вирусы и клещи (демодекс). В норме все вышеперечисленные организмы есть на коже у всех без исключения. Причем в микробиоме кожи нет «хороших» и «плохих».
«Все микробы кожи считаются условно патогенными: если при определенных условиях они начнут размножаться, это скажется на внешнем виде кожи и ее состоянии. На сегодняшний момент на 100% доказано участие ряда бактерий в развитии акне и клеща демодекса — в развитии розации. Псориаз, экзема, атопический дерматит — все эти заболевания протекают с изменением кожной микробиоты. У таких людей нарушен состав гидролипидной мантии кожи (это генетическая особенность), что и создает благоприятные условия для размножения микробов кожи. Такие состояния, как себорейный дерматит и перхоть, также связаны с избыточным размножением бактерий и грибков кожи. Изменения микробиома в этом случае происходят из-за изменения состава выделяемого кожного сала», — говорит Анна Сафонова, врач-дерматовенеролог, косметолог клиники эстетической медицины «Премиум эстетикс».
В косметику могут быть добавлены как пробитотики, так и пребиотики. Пробиотики — это сами бактерии, которые живут на нашей коже, и такую комбинацию очень сложно сделать стабильной в косметическом средстве, так как нужны специальные условия. Пребиотики — это условно пища для наших бактерий на коже.
«Пробиотики входят в состав нормальной микрофлоры нашей кожи (в основном это бифидобактерии), их лиофильно высушенные формы или фрагменты клеток. А наиболее известные пребиотики — фруктоолигосахариды и галактоолигосахариды (лактоза, глюконовая кислота и пр). Разумеется, про пребиотики из йогуртов (пектин и инулин) упоминать не стоит (но и мажут их на кожу скорее в виде исключения)», — рассказывает Елена Елисеева.
«Используются оболочки, лизаты (ферментированные микроорганизмы), ферменты, фрагменты ДНК составных частей бактерий, вирусов и грибков. Живых микроорганизмов, естественно, в такой косметике нет, так как все они являются условно патогенными. Пробиотики воздействуют на рецепторы клеток кожи, усиливая местный иммунитет и выработку противовоспалительных факторов», — дополняет Анна Сафонова.
«Существует много видов ингредиентов со свойствами пробиотиков и пребиотиков. Бифидо- и лактолизаты, инулин, альфа- и бета-глюканы: все эти компоненты будут оказывать положительное влияние на микробиом кожи и выполнять заявленные функции», — говорит Катерина Карпова, косметический химик, создатель бренда Pure Love.
Средства с пробиотиками уже представлены в косметических продуктах Lancôme, Clinique, Burt’s bees, Amala, Christina, Payot, Decleor, Dr. Pierre Ricaud, Ren, The Body Shop, «Kopa», и список производителей продолжает расти. Также ведутся разработки в российских лабораториях.
«Задачи таких средств: обеспечивать кожу полезными бактериями для ее нормального функционирования, повышать защитные свойства, блокировать воспалительные реакции, предотвращать потерю влаги, активизировать работу фибробластов, создавать антиоксидантную защиту», — рассказывает Евгения Рогожникова, косметолог-эстетист Nikolskaya Club.
Косметику с про- и пребиотиками можно рекомендовать для постоянного использования всем людям с проблемной кожей, после агрессивных процедур и при сильной чувствительности, при нарушении pH и дисбалансе.
«Также такую косметику рекомендуется применять перед и после применения агрессивных процедур — пилингов, дермабразии, лазерной терапии — для восстановления защитных функций кожи», — говорит Катерина Карпова.
«А вот ждать от пробиотиков лифтинга точно не стоит: антивозрастными свойствами такие продукты не обладают, хотя точно не повредят (особенно в рамках усиления активности антиэйдж-терапии)», — советует Елена Елисеева.
Пробиотики очень капризны и плохо сочетаются с ретинолом, сильными кератолитиками (салициловой и гликолевой кислотой), мощными антибактериальными агентами — эти компоненты слишком агрессивны. Можно, например, разнести во времени их использование.
«Производители, как правило, знают о подобных нюансах и аккуратно составляют формулу, ограничивая список компонентов, поэтому при сочетании средств одного бренда проблем обычно не возникает. Химические опыты вроде сыворотки с рекордной дозой витамина С и нанесения поверх нее крема с бактериями лучше предварительно согласовать с косметологом», — предупреждает медицинский эксперт марки Vichy.
Условия хранения косметики с пробиотиками зависят от того, какие про- или пребиотики содержатся в составе, какая использована упаковка и какие дополнительные компоненты производитель добавил в формулу. Обычно все подобные средства упакованы во флаконы-помпы или тубы с узким носиком, либо же это баночки сравнительно небольшого объема. Если производитель не прописывает каких-либо специальных условий хранения, то косметика с пробиотиками может спокойно стоять вместе со всей остальной: в темном шкафу при комнатной температуре. Но для подобных средств очень вреден прямой солнечный свет и частые перепады температуры, поэтому крем с пробиотиками категорически не стоит держать в ванной комнате.
PECULIARITIES OF THEIR INTERACTION AND OPPORTUNITIES OF THE TREATMENT WITH TOPICAL BACTERIAL LYSATE
107
ВОПРОСЫ СОВРЕМЕННОЙ ПЕДИАТРИИ /2013/ ТОМ 12/ № 1
эндоназально на протяжении 14 сут, взрослым — по 1 дозе
в каждый носовой ход до 5 раз в сут до наступления умень-
шения степени выраженности симптомов болезни. В груп-
В груп-
пе контроля проводилась стандартная терапия. Результаты
исследования продемонстрировали снижение заболевае-
мости в 2,4 раза у детей основной группы по сравне-
нию с группой контроля. Примечательно, что при воз-
никновении рецидива респираторной инфекции тяжесть
заболевания была значительно меньшей, что позволило
избежать назначения антибактериальной терапии. Среди
взрослых испытуемых отмечено сокращение продолжи-
тельности болезни, уменьшение длительности применения
противовоспалительной терапии. Изменение параметров
иммунной системы у детей и взрослых было аналогичным
и заключалось в увеличении абсолютного и относительно-
го числа CD4+ лимфоцитов, секреторного IgA и повышении
фагоцитарной активности нейтрофилов [32].
Исследование, проведенное О. В. Кладовой и соавт.
у 54 ЧБД с ОРИ, сопровождавшимися синдромом крупа
и обструктивными бронхитами, также показало сокра-
щение сроков заболевания по сравнению с группой
контроля (60 детей). Кроме того, в основной группе
Кроме того, в основной группе
больных было отмечено уменьшение частоты выделе-
ния бактериальных респираторных патогенов, усиле-
ние фагоцитарной активности макрофагов, стимуляция
интерфероногенеза, сокращение числа эпизодов ОРИ
в 1,8 раза [33].
Наличие хронических очагов инфекции в носоглотке
у детей приводит к развитию симптомов интоксикации,
снижает сопротивляемость организма, что отрицательно
сказывается на качестве жизни больного и его социали-
зации, в связи с чем особый интерес представляет изуче-
ние действия препарата у этой категории больных.
Применение топического бактериального лизата
позволяет сократить число обострений хронического
синусита, тонзиллита и аденоидита [24, 26, 31].
Благоприятное влияние препарата на микробный пей-
заж верхних дыхательных путей обусловило его успеш-
ное применение в качестве средства для профилакти-
ки послеоперационных осложнений при хирургическом
лечении заболеваний носоглотки [34].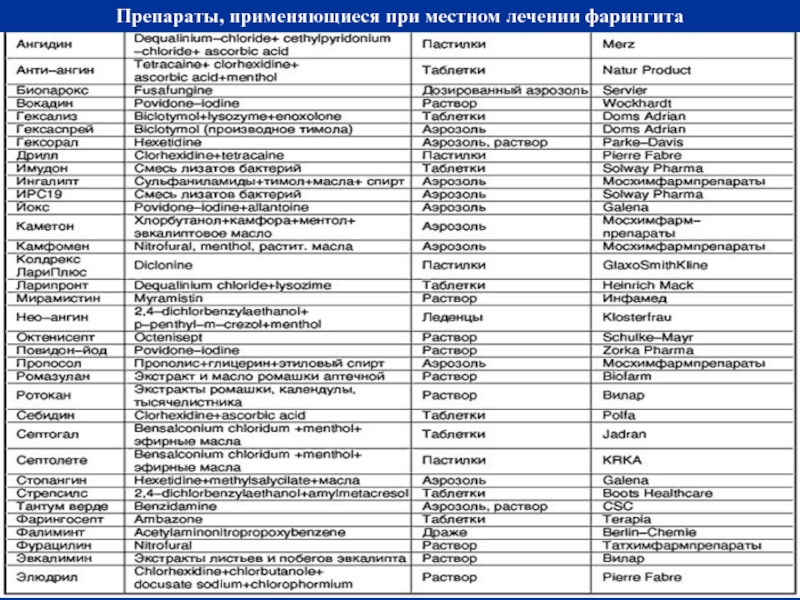
Все исследователи отмечают хорошую переносимость
препарата. Редко встречающееся усиление секреции
слизи не является противопоказанием к продолжению
терапии, эту реакцию можно рассматривать как поло-
жительную, т. к. она способствует более эффективному
очищению дыхательных путей.
Таким образом, более чем 10-летний опыт примене-
ния ИРС 19 при острых рецидивирующих хронических
заболеваниях дыхательных путей и ЛОР-органов убеди-
тельно доказывает его потенцирующее влияние на мест-
ный противоинфекционный иммунный ответ, благоприят-
ное воздействие на микробиоценоз верхних дыхательных
путей. Это способствует ускорению выздоровления при
острых инфекционных болезнях носоглотки, снижает их
частоту, сокращает число обострений хронических вос-
палительных заболеваний респираторного тракта и ЛОР-
органов, предотвращает бактериальные осложнения и
минимизирует необходимость дополнительной терапии
антибактериальными препаратами.
1. URL: http://www.who.int/en
2.
Kolbin A. S. Pediatricheskaja farmakologija — Pediatric
pharmacology. 2007; 4 (3): pp. 26–34
.
3. Vareille M., Kieninger E., Edwards M. R., Regamey N. Clin.
Microbiol. Rev. 2011; 24 (1): 210–229.
4.
WHO. Weekly Epidemiological Bulletin #42.2008; 83: 373–384;
http://www.who/int/immunisation/documents/Russian_PPV23_
translation_15_Dec_08/pdf
5. Marriott H. M., Mitchell T. J., Dockrell D. H. Curr. Mol. Med. 2008;
8 (6): 497–509.
6. Rubins J. B., Janoff E. N. J. Lab. Clin. Med. 1998; 131 (1): 21–27.
7. Gudis D., Zhao K. Q., Cohen N. A. Am. J. Rhinol. Allergy.
2012; 26 (1): 1–6.
8.
Brook I., Shah K. Ann. Otol. Rhinol. Laryngol. 2001; 110 (9): 844–848.
9. Khair O. A., Devalia J. L., Abdelaziz M. M., Sapsford R. J., Tarraf H.,
Davies R. J. ERJ. 1994; 7 (12): 2109–2116.
10. Sabroe I., Read R. C., Whyte M. K. B. et al. J. Immunol. 2003;
K. B. et al. J. Immunol. 2003;
171 (4): 1630–1635.
11.
Kozlov I. G., Timakov M. A. Pediatriya. Zhurnal imeni G. N. Speran-
skogo — Pediatrics. 2009; 87 (4): pp. 140–149.
12. Kondratenko I. V., Bologov A. A. Primary immunodeficiencies.
Moscow: Medpraktika. 2010. 231 pp
.
13. Costelloe C., Metcalfe C., Lovering A., Mant D., Hay A. D. BMJ.
2010; 340: 2096.
14. Brook I., Foote P. A., Hausfeld J. N. J. Med. Microbiol. 2008; 57
(8): 1015–1017.
15. Risnes K. R., Belanger K., Murk W., Bracken M. B. Am. J.
Epidemiol. 2011; 173 (3): 310–318.
16. WHO global strategy for containment of antimicrobial
resistance. Geneva: World Health Organization. 2001 (WHO/CDS/
CSR/DRS/2001.2).
17.
Acute respiratory diseases in children: treatment and prophylaxis.
Scientific-practical program of Union of Pediatricians of Russia. Moscow:
International Fund of Healthcare of Mother and Child. 2004. 68 pp.
2004. 68 pp.
18.
Albitskiy V.Yu., Baranov A. A. Frequently ailing children: clinical and
social aspects. The way of health improvement. Saratov. 1986. 228 pp.
19. Namazova L. S. Lechashhij vrach — Practicing Doctor. 2002;
6: pp. 36–42.
20. Vishneva Ye. A., Alekseyeva A. A., Margiyeva T. V., Voznesenskaya N. I.
Pediatricheskaja farmakologija — Pediatric pharmacology. 2011;
8 (6): pp. 106–112.
21. Yartsev M. N., Plakhtiyenko M. V. Collection of thematic articles in
frames of a project “OLIMP” on the fundamentals of clinical immunology
for pediatricians. Russian allergological journal (appendix). Farmarus
Print Medi. 2010. Pp. 29–45.
22. Korovina N. A., Lepiseva I. V., Zaplatnikova L. V., Suzdalenkov A. V.,
Ivanov V. A. Pediatriya. Zhurnal imeni G. N. Speranskogo — Pediatrics.
2009; 88 (5): pp. 104–109.
23. Karaulov A. V. Clinical immunology and allergology. Moscow: MIA.
2002. 656 pp.
24. Garashchenko T. I., Bogomilskiy M. R., Markova T. P. Consilium
medicum (appendix “Pediatrics”). 2002; 1: pp. 7–13.
25. Kotov R. V., Rakhmanova I. V. Voprosi sovremennoi pediatrii —
Current Pediatrics. 2012; 1: pp. 107–111.
26. Garashchenko T. I., Volodarskaya V. G. Voprosi sovremennoi
pediatrii — Current Pediatrics. 2009; 8 (6): pp. 109–112.
27. Balabolkin I. I., Bulgakova V. A., Sentsova T. B., Katosova L. K.
Russian bulletin of perinatology and Pediatrics. 2001; 6: pp. 56–59
.
28. Charon J., Seidel S., Wray D. Gas. Med. France. 1984;
91 (2): 71–76.
29.
Shmeleva N. I., Leonova M. V., Yefremenkova O. V. Children’s
doctor. 2000; 6: pp. 16–18.
30. Bogomilskiy M. R., Garashchenko T. I., Radtsig Ye.Yu., Streb ko-
va O. A., Skvira I.Ye. Children’s doctor. 2000; 2: 10–13.
31. Tikhomirova I. A., Ryazantsev S. V. Russian otorhinolaryngologist.
2009; 1: pp. 188–193.
32. Karaulov A. V., Sokurenko S. I., Barmotin G. V. Immunopathology.
2000; 1: pp. 71–73.
33. Kladova O. V., Uchaykin V. F. Children’s infections. 2006;
5 (4): pp. 51–54.
34. Akulich I. I., Lopatin A. S. Bulletin of otorhinolaryngology. 2006;
1: pp. 43–45.
REFERENCES
Лизаты бифидобактерий — вместо крема для лица
Лизаты — один из лучших уходовых компонентов, о котором, к сожалению, мало кто знает. Исправляем ситуацию!
Чтобы понять, как действуют лизаты, нужно кое-что знать о нашей коже. Дерма является пристанищем для нескольких сотен, а то и тысяч штаммов микроорганизмов. Микробиом кожи смело можно назвать вторым геномом. Состав микрофлоры кожи, как и кишечника, абсолютно уникален.
Одна из основных функций микробиома кожи — поддержка оптимального уровня pH и иммунная защита. Чем разнообразнее микробиом, тем устойчивее кожа к различным стресс-факторам и инфекциям.
Зачастую от вмешательства в pH кожи различными косметическими средствами, в том числе антибактериальными, микрофлора кожи обедняется, что ведет к усиленному размножению патогенных микроорганизмов и, как следствие, к различным дерматологическим заболеваниям.
На микробиом кожи непосредственно влияет состояние кишечника, а на него, в свою очередь, образ жизни: быстрые углеводы в питании, стресс, антибактериальные средства, возраст и т. д.
Что такое лизаты бактерий и как они производятся
Необходимые бактерии высевают в питательных средах и выдерживают там несколько дней, после чего их подвергают гидролизу при помощи специальных ферментов. В результате получается продукт жизнедеятельности бактерий, состоящий из различных пептидов, полисахаридов, пептидогликанов — всего, на чем с удовольствием будет плодиться дружественная коже микрофлора. Фактически, лизаты — это пробиотик для кожи. А нормальная микрофлора, как мы уже говорили, и есть необходимый фактор для регенерации и защиты дермы, препятствующий ее старению и воспалительным процессам.
Особенно пробиотическая поддержка необходима после стрессовых для кожи воздействий: солнца, лазера, кислотных и механических пилингов и даже скрабирования, так как все они приводят к снижению местного иммунитета.
Препараты с лизатами бактерий
На рынке большей частью представлены Lactobacillus Ferment Lysate для атопиков и людей с повышенной потливостью. Propionibacterium Lysate универсален, поэтому так же распространен. Во многих средствах лизаты используются в комплексе.
Самый дешевый вариант, который можно приготовить в домашних условиях:
на 100 мл воды или гидролата ввести 5−10 мл лизата.
Полученную смесь хранить в холодильнике. Рабочий диапазон pH в этом случае будет 3,8−7,0. Никакие дополнительные тоники или маски добавлять не нужно.
Лизаты — вполне самостоятельное средство, его можно использовать в качестве тоника или сыворотки на протяжении длительного периода. Это не экспресс-средство!
Это не экспресс-средство!
Готовые средства, содержащие лизаты бифидобактерий:
- Benton, Fermentation Essence
- Сыворотка для лица Bifida Ferment Lysate
- Ампульная сыворотка со 100% содержанием лизата бифидобактерий Bifida Ferment Lysate 100
- Спрей, содержащий Lactobacillus Ferment Lysate, Bifida Ferment Lysate, Lactococcus Ferment Lysate в качестве пребиотиков. Помимо этого содержит еще и пробиотики.
- Bifida Complex Ampoule содержит 90% ферментов бифидо- и лактобактерий
Курсами можно протирать лицо нормофлоринами, но они, в отличие от лизатов, нестабильны. При сыпи можно пользоваться бактериофагами.
границ | Бактериальные лизаты как иммунотерапия респираторных инфекций: методы подготовки
Введение
Инфекции дыхательных путей (ИРО), такие как острый бронхит, внебольничная пневмония (ВП) и другие, являются наиболее распространенными инфекционными заболеваниями людей и вызывают миллионы смертей ежегодно во всем мире (Всемирная организация здравоохранения, 2017). Кроме того, респираторные инфекции являются основным сопутствующим фактором хронической обструктивной болезни легких (ХОБЛ).Хотя за последние пару десятилетий были достигнуты значительные улучшения в лечении и контроле за бременем этих инфекций, все еще отсутствует вакцина против большинства инфекционных агентов, вызывающих ИРО; поэтому необходимо разработать другие профилактические стратегии (Cazzola et al., 2008; Esposito et al., 2018). Одной из стратегий лечения этих инфекций является использование бактериальных лизатов (BL), которые были введены в 1970-х годах в качестве пероральных вакцин для профилактики и лечения ИРО (Cazzola et al., 2012а; Hancock et al., 2012; Эспозито и др., 2018). Эти лизаты представляют собой смеси антигенов, происходящих от инактивированных патогенов, часто участвующих в ИРО.
Кроме того, респираторные инфекции являются основным сопутствующим фактором хронической обструктивной болезни легких (ХОБЛ).Хотя за последние пару десятилетий были достигнуты значительные улучшения в лечении и контроле за бременем этих инфекций, все еще отсутствует вакцина против большинства инфекционных агентов, вызывающих ИРО; поэтому необходимо разработать другие профилактические стратегии (Cazzola et al., 2008; Esposito et al., 2018). Одной из стратегий лечения этих инфекций является использование бактериальных лизатов (BL), которые были введены в 1970-х годах в качестве пероральных вакцин для профилактики и лечения ИРО (Cazzola et al., 2012а; Hancock et al., 2012; Эспозито и др., 2018). Эти лизаты представляют собой смеси антигенов, происходящих от инактивированных патогенов, часто участвующих в ИРО.
За последние несколько десятилетий к БЛ вновь обратили внимание из-за их вклада в сокращение рецидивов ИРО в детстве (Gutiérrez-Tarango and Berber, 2001; Rozy and Chorostowska-Wynimko, 2008; Navarro et al. , 2011). Сообщалось также о положительных результатах лечения хронической обструктивной болезни легких (ХОБЛ) у взрослых (Cazzola et al., 2012b; Kearney et al., 2015). Исследования показали, что BL являются эффективными иммуностимуляторами, вызывая специфические реакции в локальных областях иммунной системы слизистой оболочки (Braido et al., 2007, 2011; Cazzola et al., 2012b; Kearney et al., 2015).
, 2011). Сообщалось также о положительных результатах лечения хронической обструктивной болезни легких (ХОБЛ) у взрослых (Cazzola et al., 2012b; Kearney et al., 2015). Исследования показали, что BL являются эффективными иммуностимуляторами, вызывая специфические реакции в локальных областях иммунной системы слизистой оболочки (Braido et al., 2007, 2011; Cazzola et al., 2012b; Kearney et al., 2015).
Несмотря на широкое клиническое использование BL, их влияние на иммунную систему известно лишь частично. Данные большинства исследований показывают, что BL действуют как иммуномодуляторы, способные индуцировать антитела против определенных патогенов, а также иммунорегуляторные реакции в тканях слизистой оболочки (Braido et al., 2011; Cazzola et al., 2012b; Kearney et al., 2015; Эспозито и др., 2018; Triantafillou et al., 2019). В частности, было продемонстрировано, что они могут взаимодействовать с различными клетками через компоненты бактериальной стенки, такие как протеогликаны или липополисахариды, которые взаимодействуют с Toll-подобными рецепторами (TLR) на моноцитах / макрофагах, дендритных или эпителиальных клетках. Эти взаимодействия стимулируют дифференцировку моноцитов в макрофаги и активируют незрелые дендритные клетки, что приводит к выработке выбранных хемокинов и цитокинов.В целом, эти ответы будут вызывать рекрутирование врожденных эффекторных клеток на участки слизистой оболочки и индуцировать активацию лимфоцитов, которая может помочь в защите от вторжения патогенов. Некоторые авторы предполагают, что эти ответы действительно создают состояние «предварительной готовности» против инфекции (Kearney et al., 2015).
Эти взаимодействия стимулируют дифференцировку моноцитов в макрофаги и активируют незрелые дендритные клетки, что приводит к выработке выбранных хемокинов и цитокинов.В целом, эти ответы будут вызывать рекрутирование врожденных эффекторных клеток на участки слизистой оболочки и индуцировать активацию лимфоцитов, которая может помочь в защите от вторжения патогенов. Некоторые авторы предполагают, что эти ответы действительно создают состояние «предварительной готовности» против инфекции (Kearney et al., 2015).
Отсутствие стандартизованных протоколов может быть препятствием для экспериментальной воспроизводимости иммуностимулирующих эффектов. Разные авторы работали с разными фракциями клеток микроорганизмов в качестве компонентов BL.В частности, различные методы, с помощью которых были приготовлены лизаты, могли способствовать несогласованности между их зарегистрированными биологическими эффектами. Возможно, отсутствие строгости в дизайне эксперимента, недостаточное количество пациентов или другие технические недостатки привели к некоторому уровню недоверия к проведенным клиническим испытаниям (Cazzola et al. , 2008). Стандартизированные производственные протоколы были бы полезным шагом на пути к преодолению некоторых из текущих трудностей, связанных со сравнением биологических эффектов BL.
, 2008). Стандартизированные производственные протоколы были бы полезным шагом на пути к преодолению некоторых из текущих трудностей, связанных со сравнением биологических эффектов BL.
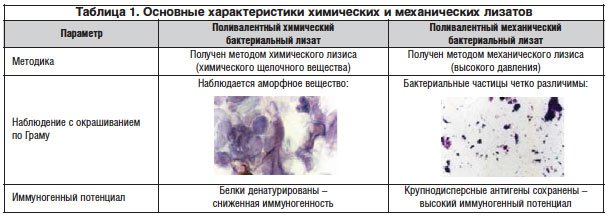
Двумя наиболее распространенными методами, используемыми для лизиса бактерий, являются щелочная обработка и механическое разрушение, хотя также использовались тепло или детергенты (Bauer et al., 2008; Braido et al., 2011; Cazzola et al., 2012a). Щелочной лизис может вызывать денатурацию белков бактериальных антигенов, тогда как механическое разрушение предположительно не изменяет антигенные структуры в BL (Kearney et al., 2015; Jurkiewicz and Zielnik-Jurkiewicz, 2018; Triantafillou et al., 2019). Каждый бактериальный штамм выращивают независимо, собирают, инактивируют выбранной процедурой и затем необязательно лиофилизируют.Индивидуальные лизаты смешивают в фиксированных пропорциях, чтобы получить поливалентный BL.
Коммерческие поливалентные бактериальные лизаты доступны в форме пероральных капсул или сублингвальных таблеток (Таблица 1; Европейское агентство по лекарственным средствам, 2019). Среди наиболее известных — Broncho-Vaxom ® в качестве примера бактериального иммуностимулятора, полученного путем химического лизиса, и Ismigen ® или Ribomunyl-D 53, состоящих из неизмененных антигенных частиц, полученных путем механического разрушения клеток (Braido et al., 2007; Cazzola et al., 2008). Другие коммерчески доступные БС используются для лечения других инфекций, таких как инфекции мочевыводящих путей (Huber et al., 2000; Bauer et al., 2002, 2015; Aziminia et al., 2019; Wawrysiuk et al., 2019) или при рецидиве туберкулеза (Дячик, 2006), тоже с хорошими результатами.
Среди наиболее известных — Broncho-Vaxom ® в качестве примера бактериального иммуностимулятора, полученного путем химического лизиса, и Ismigen ® или Ribomunyl-D 53, состоящих из неизмененных антигенных частиц, полученных путем механического разрушения клеток (Braido et al., 2007; Cazzola et al., 2008). Другие коммерчески доступные БС используются для лечения других инфекций, таких как инфекции мочевыводящих путей (Huber et al., 2000; Bauer et al., 2002, 2015; Aziminia et al., 2019; Wawrysiuk et al., 2019) или при рецидиве туберкулеза (Дячик, 2006), тоже с хорошими результатами.
Таблица 1 . Характеристики и клинические результаты коммерческих бактериальных лизатов, используемых для лечения ИРТ.
Типы бактериальных лизатов
Щелочные бактериальные лизаты
Щелочной лизис использует ионы гидроксида натрия для разрушения структуры клеточной мембраны за счет изменения pH до 11.5–12,5.
Одним из первых бактериальных лизатов, полученных щелочной экстракцией, был Lantigen B, чьи эффекты in vivo и были впервые описаны в 1970-х годах (Tyrrell et al. , 1972) и недавно продемонстрированы Braido et al. (2014). Позже Bauer et al. (1995) запатентовали другой процесс, который включал культивирование Escherichia coli в водной среде с последующей щелочной экстракцией бактериальных белков в присутствии «разбавленного водного источника ионов ОН-.Используемый процесс щелочного лизиса включал концентрирование, ультрафильтрацию, диафильтрацию лизата и лиофилизацию. Авторы далее описали экстракцию липополисахаридов (LPS) с помощью ионообменной хроматографии и характеристику лизата с помощью биохимических анализов аминокислот, рацемизированных во время щелочной экстракции. Кроме того, в патент включены другие процессы лизиса бактерий, вызывающих ИРО, с изменением концентраций гидроксида натрия (NaOH) (Таблица 2; Bauer et al., 1995).
, 1972) и недавно продемонстрированы Braido et al. (2014). Позже Bauer et al. (1995) запатентовали другой процесс, который включал культивирование Escherichia coli в водной среде с последующей щелочной экстракцией бактериальных белков в присутствии «разбавленного водного источника ионов ОН-.Используемый процесс щелочного лизиса включал концентрирование, ультрафильтрацию, диафильтрацию лизата и лиофилизацию. Авторы далее описали экстракцию липополисахаридов (LPS) с помощью ионообменной хроматографии и характеристику лизата с помощью биохимических анализов аминокислот, рацемизированных во время щелочной экстракции. Кроме того, в патент включены другие процессы лизиса бактерий, вызывающих ИРО, с изменением концентраций гидроксида натрия (NaOH) (Таблица 2; Bauer et al., 1995).
Таблица 2 . Способы приготовления бактериальных лизатов.
Бауэр и другие сотрудники запатентовали спустя годы бактериальный экстракт для респираторных инфекций с кратким описанием процесса его приготовления. Это был щелочной лизат, экстрагированный из штаммов бактерий Staphylococcus aureus, Moraxella catarrhalis, Klebsiella pneumoniae, Streptococcus pneumoniae и Haemophilus influenzae (Bauer et al., 2008, 2010).Процесс лизирования, описанный в патенте, охватывал ряд разнообразных возможных условий на разных стадиях процесса, от ферментации бактерий до полученной модифицированной белковой смеси. По мнению авторов, щелочной лизис каждого штамма или набора штаммов подходит для всех бактерий, вызывающих ИРО.
Это был щелочной лизат, экстрагированный из штаммов бактерий Staphylococcus aureus, Moraxella catarrhalis, Klebsiella pneumoniae, Streptococcus pneumoniae и Haemophilus influenzae (Bauer et al., 2008, 2010).Процесс лизирования, описанный в патенте, охватывал ряд разнообразных возможных условий на разных стадиях процесса, от ферментации бактерий до полученной модифицированной белковой смеси. По мнению авторов, щелочной лизис каждого штамма или набора штаммов подходит для всех бактерий, вызывающих ИРО.
Среди имеющихся в продаже составов, полученных щелочным лизисом, есть OM-85 BV (Broncho-Vaxom ® ) и Liuvac (LW-50020). OM-85 BV (Broncho-Vaxom ® ) представляет собой смесь H.influenzae, S. pneumoniae, K. pneumoniae, Klebsiella ozaenae, S. aureus, Streptococcus pyogenes, Streptococcus viridans и M. catarrhalis . Лювак представляет собой смесь бактериальных лизатов из S. aureus, S. pneumoniae, S. pyogenes, K. pneumoniae, M.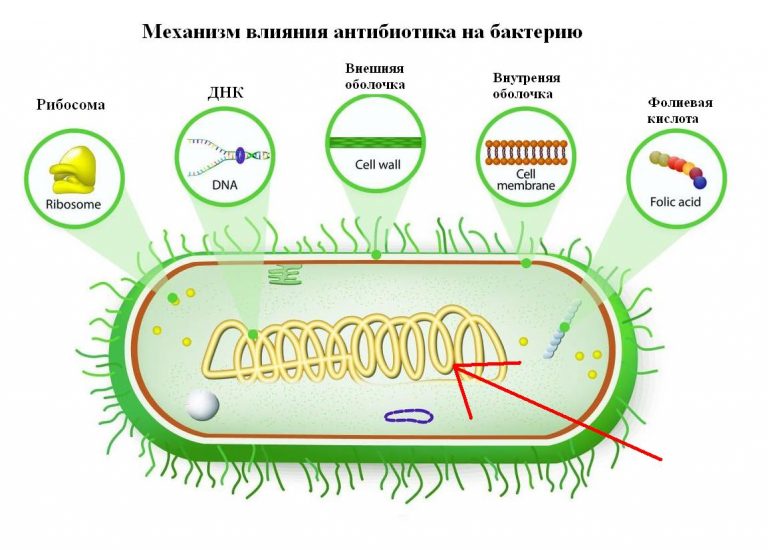 catarrhalis и H. influenzae , которая также была оценена для лечения хронического бронхита и ХОБЛ ( Cazzola et al., 2008, 2012b; Esposito et al., 2018).
catarrhalis и H. influenzae , которая также была оценена для лечения хронического бронхита и ХОБЛ ( Cazzola et al., 2008, 2012b; Esposito et al., 2018).
Для препаратов бактериального лизата торговой марки, таких как OM-85 BV (Broncho-vaxom ® ), нет доступа к подробному протоколу приготовления, в котором указываются, например, концентрации NaOH, температуры или периоды, используемые для процесса лизиса клеток.
Механические бактериальные лизаты
Наиболее широко применяемыми механическими методами лизиса бактериальных клеток являются ультразвуковая обработка и гомогенизация под высоким давлением. Для гомогенизации используются разные давления в зависимости от типа клеток (Goldberg, 2008).
В одном из первых патентов на механическое получение бактериального лизата, обнаруженных в литературе, сообщалось об использовании обезвоженных и частично лизированных бактериальных антигенов (Illiarten, 1971). Автор описал лизис S.aureus, K. pneumoniae, Haemophilus influenzae, S. pneumoniae и M. catarrhalis , путем медленного замораживания с последующим быстрым оттаиванием суспензии клеток в различных диапазонах температур с обработкой ультразвуком в течение разных периодов времени (таблица 2).
pneumoniae, Haemophilus influenzae, S. pneumoniae и M. catarrhalis , путем медленного замораживания с последующим быстрым оттаиванием суспензии клеток в различных диапазонах температур с обработкой ультразвуком в течение разных периодов времени (таблица 2).
Melioli и Fasani запатентовали механически лизируемый препарат из S. aureus, K. pneumoniae, S. pneumoniae, Haemophilus influenzae и M. catarrhalis , отдельно или в комбинации (Melioli and Fasani, 2004).Бактериальные лизаты в виде частиц получали путем фрагментации бактериальных клеток с использованием клапана высокого давления с последующим отделением неизмененной фракции антигенных частиц от растворимых компонентов центрифугированием, промывкой и фильтрацией (таблица 2).
Позже Coviello et al. (2014) описали механически приготовленные лизаты из S. pneumoniae, M.catarrhalis, K. pneumoniae, Micrococcus spp, Haemophilus influenza и Streptoccocus spp.(например, Streptococcus anhemoliticus и S. viridans ) с помощью обработки ультразвуком для разрушения стенок бактериальных клеток. В их конкретном процессе лизиса бактериальный материал подвергался циклам изменения температуры перед тем, как лизат был проанализирован, чтобы подтвердить, что не осталось никаких жизнеспособных организмов (таблица 2; Coviello et al., 2014).
viridans ) с помощью обработки ультразвуком для разрушения стенок бактериальных клеток. В их конкретном процессе лизиса бактериальный материал подвергался циклам изменения температуры перед тем, как лизат был проанализирован, чтобы подтвердить, что не осталось никаких жизнеспособных организмов (таблица 2; Coviello et al., 2014).
Крупнейшим представителем на рынке препаратов механических лизатов является Ismigen ® , который представляет собой поливалентный механический бактериальный лизат (PMBL), состоящий из лизатов из S.aureus, S. pyogenes, S. viridans, K. ozaenae, H. influenzae , тип b , M. catarrhalis и S. pneumoniae .
Другой тип механических лизатов — лизаты, богатые рибосомами. Их получают путем разрушения клеток микростеклянными шариками в гомогенизаторе, методика, впервые описанная в 1965 году (Youmans and Youmans, 1965). Эти авторы показали, что рибосомная фракция, полученная из разрушенных микобактерий, проявляла высокую иммуногенность. С тех пор различные авторы изучали защиту животных с использованием рибосомных фракций бактерий, таких как S.pneumoniae, Salmonella Typhimurium и Neisseria meningitidis (Томпсон и Снайдер, 1971; Веннеман и Берри, 1971; Томас и Вайс, 1972; Свендсен и Джонсон, 1976). Затем Мишель и др. (1978) описали препарат рибосом, экстрагированный из бактериальной биомассы после бактериальной ферментации с последующим механическим разрушением под давлением при низкой температуре, серию центрифугирования для удаления целых клеток и несколько этапов фильтрации и стерилизации для получения бактериального лизата (таблица 2; Michel et al. ., 1978). Позже Dussourd d’Hinterland и его коллеги продали интраназальную поливалентную рибосомную вакцину для людей под названием Ribomunyl-D 53, состоящую из рибосомных препаратов из K. pneumoniae, S. pneumoniae, S. pyogenes группы A и Haemophilus influenzae с мембранный протеогликан некапсулярного штамма K. pneumoniae в качестве адъюванта (Dussourd d’Hinterland et al.
С тех пор различные авторы изучали защиту животных с использованием рибосомных фракций бактерий, таких как S.pneumoniae, Salmonella Typhimurium и Neisseria meningitidis (Томпсон и Снайдер, 1971; Веннеман и Берри, 1971; Томас и Вайс, 1972; Свендсен и Джонсон, 1976). Затем Мишель и др. (1978) описали препарат рибосом, экстрагированный из бактериальной биомассы после бактериальной ферментации с последующим механическим разрушением под давлением при низкой температуре, серию центрифугирования для удаления целых клеток и несколько этапов фильтрации и стерилизации для получения бактериального лизата (таблица 2; Michel et al. ., 1978). Позже Dussourd d’Hinterland и его коллеги продали интраназальную поливалентную рибосомную вакцину для людей под названием Ribomunyl-D 53, состоящую из рибосомных препаратов из K. pneumoniae, S. pneumoniae, S. pyogenes группы A и Haemophilus influenzae с мембранный протеогликан некапсулярного штамма K. pneumoniae в качестве адъюванта (Dussourd d’Hinterland et al. , 1980). Было проведено несколько исследований, показывающих его эффективность в качестве иммуностимуляторов (Lauener, 1994; Clot, 1997; Caliot et al., 2000; Bellanti et al., 2003; Буске и Фиокки, 2006). По сравнению со щелочными бактериальными экстрактами, такими как OM85 BV, было показано, что D53 индуцирует большее количество продуцирующих антитела клеток в миндалинах детей, подвергшихся лечению, и авторы предположили, что частично транскрибируемые белки, присутствующие в обогащенном рибосомами препарате, могут содержать мощные эпитопы, которые будут взаимодействовать с иммунокомпетентными клетками. более эффективно, чем крупные белки, присутствующие в бактериальном экстракте (Béné et al., 1993).
, 1980). Было проведено несколько исследований, показывающих его эффективность в качестве иммуностимуляторов (Lauener, 1994; Clot, 1997; Caliot et al., 2000; Bellanti et al., 2003; Буске и Фиокки, 2006). По сравнению со щелочными бактериальными экстрактами, такими как OM85 BV, было показано, что D53 индуцирует большее количество продуцирующих антитела клеток в миндалинах детей, подвергшихся лечению, и авторы предположили, что частично транскрибируемые белки, присутствующие в обогащенном рибосомами препарате, могут содержать мощные эпитопы, которые будут взаимодействовать с иммунокомпетентными клетками. более эффективно, чем крупные белки, присутствующие в бактериальном экстракте (Béné et al., 1993).
В целом, механическое разрушение клеток оказалось эффективным методом, обеспечивающим лизис 80–100% бактерий (Cazzola et al., 2012а). Как ранее предлагали другие авторы, механические лизаты содержат частицы, которые сохраняют некоторые свойства интактных антигенных молекул, обеспечивая тем самым лучшее взаимодействие с Toll-подобными рецепторами, что является одной из первоначальных целей этих препаратов (Villa et al. , 2010; Cazzola et al. ., 2012a, b; Esposito et al., 2018; Triantafillou et al., 2019). Однако этот способ имеет ограничение тепловыделения, которое необходимо минимизировать, чтобы избежать денатурализации белка в процессе, и он более дорог, чем щелочной лизис.
, 2010; Cazzola et al. ., 2012a, b; Esposito et al., 2018; Triantafillou et al., 2019). Однако этот способ имеет ограничение тепловыделения, которое необходимо минимизировать, чтобы избежать денатурализации белка в процессе, и он более дорог, чем щелочной лизис.
Препараты бактериальных лизатов бактериофагами
Бактериальные лизаты, полученные путем заражения бактерий выбранными бактериофагами, были запатентованы в 2011 году Пиллихом и Балкареком, которые работали с бактериальными лизатами с 2003 года (Pillich and Balcarek, 2011). Первоначальная идея восходит к 1917 году, когда использование бактериофагов для лечения бактериальных заболеваний было предложено D ‘Herelle (Fruciano and Bourne, 2007).
Авторы приготовили лизаты бактерий из штаммов S.aureus, K. pneumoniae и Pseudomonas aeruginosa . Они инкубировали бактериофаги с бактериальной культурой в течение определенного периода. Полученные лизаты, содержащие клеточные материалы, такие как компоненты клеточной стенки, клеточные мембраны, белки, рибосомные фракции, гликопротеины, ДНК и РНК, затем фильтровали и стерилизовали. Авторы предположили, что использование бактериофагов эффективно против всех видов бактерий.
Авторы предположили, что использование бактериофагов эффективно против всех видов бактерий.
Поскольку протокол запатентован, авторы не предоставили конкретных подробностей о времени инкубации или дозах бактериофагов.Тем не менее, приводится приблизительная концентрация культуры бактериофагов, а также приблизительное время инкубации (от 3 до 48 часов). Методы, используемые для определения антигенного паттерна, приведены в таблице 2 (Rothbard et al., 2014).
Клинические эффекты
Было проведено множество клинических исследований для оценки иммуностимулирующего эффекта бактериальных лизатов, оцениваемого как положительное воздействие на пациентов, восприимчивых к инфекциям дыхательных путей (ИРО) в детском, пожилом возрасте или пациентов с ХОБЛ.Среди всех бактериальных лизатов, описанных в литературе, наибольшее количество клинических испытаний было выполнено на OM-85 BV (Broncho-vaxom ® ) и Ismigen ® (PMBL) в качестве примеров химического или механического лизиса соответственно (Bessler et al. , 2010; Navarro et al., 2011; Lanzilli et al., 2013; Tang et al., 2015).
, 2010; Navarro et al., 2011; Lanzilli et al., 2013; Tang et al., 2015).
OM-85 продемонстрировал хорошую безопасность и переносимость во многих исследованиях с сокращением рецидивов респираторных инфекций у детей и взрослых (Jara-Pérez and Berber, 2000; Gutiérrez-Tarango and Berber, 2001; Solèr et al., 2007; Шаад, 2010). Метаанализ восьми рандомизированных контролируемых исследований, проведенных Schaad et al., Показал снижение случаев рецидивов ИРО среди детей, получавших OM-85 (Schaad, 2010). Затем другой метаанализ также подтвердил эти данные и показал защитный эффект OM-85 в отношении рецидивирующих ИРО у детей (Yin et al., 2018; Esposito et al., 2019). Что касается пациентов с ХОБЛ, метаанализ, опубликованный Pan et al., Пришел к выводу, что имеющихся данных недостаточно для подтверждения положительного эффекта OM-85BV у пациентов с ХОБЛ с точки зрения продолжительности госпитализации, тяжести обострения и общего количества побочных эффектов. (Пан и др., 2015).
В целом авторы согласны с тем, что среди уже проведенных исследований есть некоторые ограничения, поэтому существует необходимость в высококачественных, больших, многоцентровых, двойных слепых, плацебо-контролируемых рандомизированных клинических исследованиях, чтобы подтвердить роль иммуностимуляторов в предотвращение ИРТ у детей (Del-Rio-Navarro et al. , 2012), а также взрослых или пациентов с ХОБЛ (Pan et al., 2015).
, 2012), а также взрослых или пациентов с ХОБЛ (Pan et al., 2015).
С другой стороны, существует также множество клинических исследований с использованием BL, полученных путем механического разрушения, показывающих многообещающие результаты.Rosaschino и Cattaneo (2004) оценили эффективность и переносимость у педиатрических пациентов, получавших PMBL, и продемонстрировали, что лечение было эффективным при отличной переносимости BL (Rosaschino and Cattaneo, 2004). Брейдо и Мелиоли изучали другой препарат лизата, названный Лантиген В, у пациентов с рецидивирующими ИРО и продемонстрировали значительное снижение количества острых эпизодов у этих пациентов (Braido et al., 2014).
Результаты активности BL в качестве вакцины были описаны как частично зависящие от используемого патогенного штамма, частично (в случае рибосомных BL) от степени чистоты субклеточной фракции и частично от присутствия или отсутствия других клеточных компонентов. такие как полисахариды (Michel et al., 1978).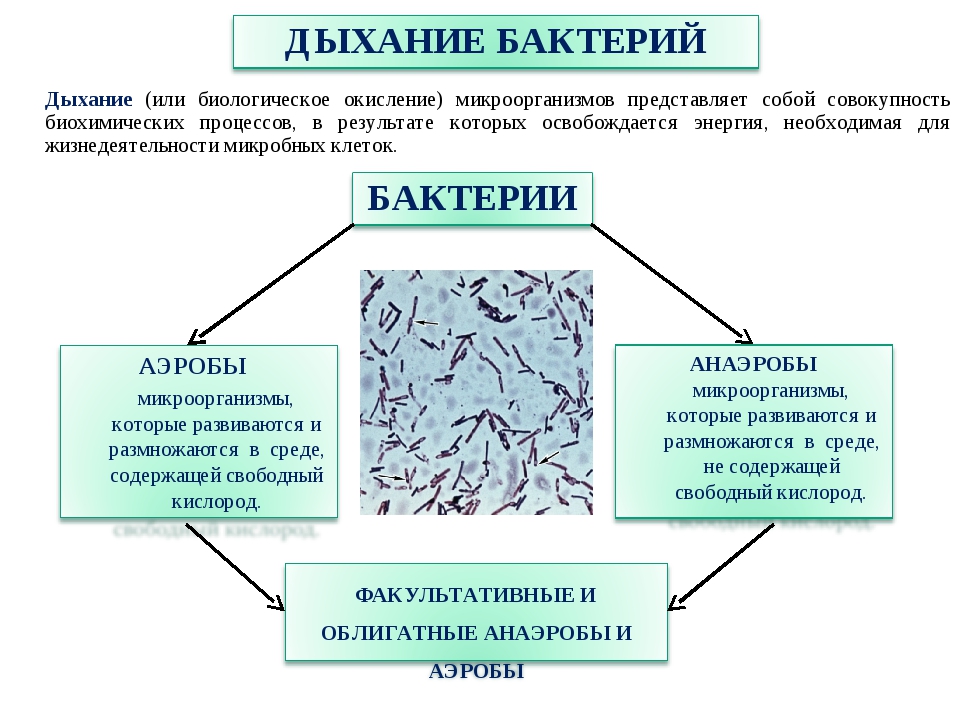 Различные типы иммунных ответов (клеточно-опосредованные или гуморальные) были вызваны в разных исследованиях. Пути введения включают назальный, сублингвальный, а также оральный (Schaad, 2010; Cazzola et al., 2012a; Rial et al., 2016).
Различные типы иммунных ответов (клеточно-опосредованные или гуморальные) были вызваны в разных исследованиях. Пути введения включают назальный, сублингвальный, а также оральный (Schaad, 2010; Cazzola et al., 2012a; Rial et al., 2016).
Таким образом, несколько исследований показали положительные эффекты лечения бактериальными экстрактами, полученными с помощью механических или химических процедур. Как уже упоминалось, некоторые авторы заявили, что механическое разрушение может быть лучшей альтернативой химическому лизису из-за сохранения антигенов.Однако не было проведено исследований, сравнивающих биологические эффекты поливалентных бактериальных лизатов, приготовленных из тех же бактериальных культур, но с использованием механических или химических процедур лизата (механических или химических). Эти сравнительные исследования могут пролить свет на выбор лучшего метода приготовления лизатов иммуностимуляторов.
Перспективы на будущее
Несколько методов использовались в течение многих лет для приготовления клеточных лизатов (например, щелочная обработка или механическое разрушение). Поскольку механическое разрушение считается наиболее перспективным способом лизиса клеток, некоторые компании достигли значительного технологического прогресса в этой области (Cazzola et al., 2012a; Jurkiewicz and Zielnik-Jurkiewicz, 2018; Esposito et al., 2019 ). Они разработали сфокусированную ультразвуковую обработку, передовую технологию с компьютерным управлением, которая может контролировать дозировку энергии, доставляемой для мягкого разрушения клеточных мембран клеток млекопитающих или внезапного разрушения клеточных стенок бактерий. Эта технология может решить проблемы стандартизации процедур получения механических бактериальных лизатов (Wenger et al., 2008; Bláha et al., 2017).
Поскольку механическое разрушение считается наиболее перспективным способом лизиса клеток, некоторые компании достигли значительного технологического прогресса в этой области (Cazzola et al., 2012a; Jurkiewicz and Zielnik-Jurkiewicz, 2018; Esposito et al., 2019 ). Они разработали сфокусированную ультразвуковую обработку, передовую технологию с компьютерным управлением, которая может контролировать дозировку энергии, доставляемой для мягкого разрушения клеточных мембран клеток млекопитающих или внезапного разрушения клеточных стенок бактерий. Эта технология может решить проблемы стандартизации процедур получения механических бактериальных лизатов (Wenger et al., 2008; Bláha et al., 2017).
Выводы
В этом обзоре обобщена наиболее важная общедоступная информация по производству и использованию бактериальных лизатов. Несмотря на их важность для общественного здравоохранения и количество исследований, проводимых на клиническом уровне, существует потребность в более стандартизованных протоколах для получения этих бактериальных антигенов, поскольку в литературе нет подробного описания процедур лизиса или эти процедуры не являются общедоступными для исследовательское сообщество. Тот факт, что выбранный метод инактивации важен для эффективности бактериальных лизатов, является важным аспектом, который заслуживает тщательного изучения, особенно потому, что некоторые из этих методов лечения могут привести к денатурации антигенов. Отсутствие стандартизированных протоколов приводит к разным характеристикам экстракта в лабораториях и препятствует воспроизводимости результатов. В свою очередь, это может привести к ошибочным оценкам эффектов, производимых этими лизатами. Стандартные производственные протоколы были бы полезным шагом на пути к преодолению некоторых текущих трудностей при сравнении иммунологических и клинических эффектов BL и их использования в качестве иммунотерапии для профилактики и лечения ИРО.
Тот факт, что выбранный метод инактивации важен для эффективности бактериальных лизатов, является важным аспектом, который заслуживает тщательного изучения, особенно потому, что некоторые из этих методов лечения могут привести к денатурации антигенов. Отсутствие стандартизированных протоколов приводит к разным характеристикам экстракта в лабораториях и препятствует воспроизводимости результатов. В свою очередь, это может привести к ошибочным оценкам эффектов, производимых этими лизатами. Стандартные производственные протоколы были бы полезным шагом на пути к преодолению некоторых текущих трудностей при сравнении иммунологических и клинических эффектов BL и их использования в качестве иммунотерапии для профилактики и лечения ИРО.
Авторские взносы
NS участвовал в разработке концепции, поиске информации и помогал в составлении рукописи. FF и AR участвовали в поиске информации, помогали в составлении рукописи. VD оказал помощь в языковой коррекции. JC помогал в составлении и исправлении рукописи.
Финансирование
Работа была поддержана PEDECIBA-Química, Уругвай.
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Азиминия, Н., Хаджипавлу, М., Филиппу, Ю., Пандиан, С.С., Мальде, С., и Хаммадех, М. Ю. (2019). Вакцины для профилактики рецидивирующих инфекций мочевыводящих путей: систематический обзор. БЖУ Инт . 123, 753–768. DOI: 10.1111 / bju.14606
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бауэр, Х. В., Ральфс, В. В., Лауэнер, П. А., и Блессманн, С. С. (2002). Профилактика рецидивирующих инфекций мочевыводящих путей с помощью иммуноактивного препарата E.coli : метаанализ пяти плацебо-контролируемых двойных слепых исследований. Int. J. Antimicrob. Агенты 19, 451–456. DOI: 10.1016 / S0924-8579 (02) 00106-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бауэр, Дж. , Хирт, П., и Шультесс, А. (1995). Экстракт бактериальных макромолекул, способ его получения и фармацевтическая композиция, содержащая то же самое [Интернет]. США 00 5424287A . Доступно в Интернете по адресу: https: // www.google.com/patents/US5424287
, Хирт, П., и Шультесс, А. (1995). Экстракт бактериальных макромолекул, способ его получения и фармацевтическая композиция, содержащая то же самое [Интернет]. США 00 5424287A . Доступно в Интернете по адресу: https: // www.google.com/patents/US5424287
Google Scholar
Bauer, J. A., Salvagni, M., Vigroox, J.-P. Л., Чалвет Л. и Чиавароли К. (2008). Бактериальный экстракт для респираторных заболеваний и способ его получения [Интернет] . WO 2008/109669 A2. Вашингтон, округ Колумбия: Всемирная организация интеллектуальной собственности. Доступно в Интернете по адресу: http://www.freepatentsonline.com/8697154.html
Google Scholar
Bauer, J. A., Salvagni, M., Vigroox, J.-P. Л., Чалвет, Л., и Чиавароли, К. (2010). Бактериальный экстракт для респираторных заболеваний и способ его получения . Патент США 0227013 A1. Вашингтон, округ Колумбия: Бюро по патентам и товарным знакам США.
Google Scholar
Bauer, J. A., Salvagni, M. , Vigroux, J.-P. Л., Чалвет Л. и Чиавароли К. (2015). Бактериальный экстракт при заболеваниях пищеварительного тракта или мочевыводящих путей и способ его получения . Патент США 9,198,961 B2. Вашингтон, округ Колумбия: Бюро по патентам и товарным знакам США.
, Vigroux, J.-P. Л., Чалвет Л. и Чиавароли К. (2015). Бактериальный экстракт при заболеваниях пищеварительного тракта или мочевыводящих путей и способ его получения . Патент США 9,198,961 B2. Вашингтон, округ Колумбия: Бюро по патентам и товарным знакам США.
Google Scholar
Белланти, Дж. А., Оливьери, Д., и Серрано, Э. (2003). Рибосомная иммуностимуляция: оценка исследований, оценивающих ее клиническую значимость для профилактики инфекций верхних и нижних дыхательных путей у детей и взрослых. Биопрепараты 17, 355–367. DOI: 10.2165 / 00063030-200317050-00005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенэ М., К., Каль, Л., Перрюше, А. М., Гермес, Х., Мосгес, М., Нормье, Г., и другие. (1993). Бактериальные лизаты и рибосомы как индукторы специфических иммунных ответов: сравнительное исследование. Сканд. J. Immunol . 38, 496–498. DOI: 10.1111 / j.1365-3083.1993.tb02594.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бесслер, В. Г., Фордем Эше, У., и Масихи, Н. (2010). Бактериальный экстракт OM-85 BV защищает мышей от гриппа и сальмонеллезной инфекции. Int. Иммунофармакол . 10, 1086–1090. DOI: 10.1016 / j.intimp.2010.06.009
Г., Фордем Эше, У., и Масихи, Н. (2010). Бактериальный экстракт OM-85 BV защищает мышей от гриппа и сальмонеллезной инфекции. Int. Иммунофармакол . 10, 1086–1090. DOI: 10.1016 / j.intimp.2010.06.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Блаха, Б. А. Ф., Моррис, С. А., Огонах, О. В., и Кресенте, В. (2017). Разработка микромасштабной платформы разрушения клеток для Pichia pastoris в быстром дизайне биопроцессов. Biosep. Downstr. Процесс . 35, 130–140. DOI: 10.1002 / btpr.2555
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Буске Дж. И Фиокки А. (2006). Профилактика рецидивирующих инфекций дыхательных путей у детей с помощью рибосомального иммунотерапевтического агента: клинический обзор. Paediatr. Лекарства 8, 235–243. DOI: 10.2165 / 00148581-200608040-00003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Брайдо, Ф., Мелиоли, Г., Кандоли, П., Кавало, А., Ди Джоаккино, М. , Ферреро, В. и др. (2014). Бактериальный лизат Lantigen B снижает количество острых эпизодов у пациентов с рецидивирующими инфекциями дыхательных путей: результаты двойного слепого, плацебо-контролируемого, многоцентрового клинического исследования. Immunol. Lett .162, 185–193. DOI: 10.1016 / j.imlet.2014.10.026
, Ферреро, В. и др. (2014). Бактериальный лизат Lantigen B снижает количество острых эпизодов у пациентов с рецидивирующими инфекциями дыхательных путей: результаты двойного слепого, плацебо-контролируемого, многоцентрового клинического исследования. Immunol. Lett .162, 185–193. DOI: 10.1016 / j.imlet.2014.10.026
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Braido, F., Melioli, G., Cazzola, M., Fabbri, L., Blasi, F., Moretta, L., et al. (2015). Сублингвальное введение поливалентного механического бактериального лизата (PMBL) пациентам с умеренной, тяжелой или очень тяжелой хронической обструктивной болезнью легких (ХОБЛ) согласно спирометрической классификации GOLD: многоцентровое, двойное слепое, раннее. Легочная. Pharmacol.Ther . 33, 75–80. DOI: 10.1016 / j.pupt.2015.03.006
CrossRef Полный текст | Google Scholar
Braido, F., Schenone, G., Pallestrini, E., Reggiardo, G., Cangemi, G., Canonica, G. W., et al. (2011). Взаимосвязь между иммунным ответом слизистой оболочки и клиническим исходом у пациентов с рецидивирующими инфекциями верхних дыхательных путей, получавших механический бактериальный лизат. J. Biol. Regul. Гомеост. Агенты 25, 477–485.
Взаимосвязь между иммунным ответом слизистой оболочки и клиническим исходом у пациентов с рецидивирующими инфекциями верхних дыхательных путей, получавших механический бактериальный лизат. J. Biol. Regul. Гомеост. Агенты 25, 477–485.
PubMed Аннотация | Google Scholar
Брайдо, Ф., Тарантини, Ф., Гильоне, В., Мелиоли, Г., и Каноника, Г. У. (2007). Бактериальный лизат для профилактики обострения ХОБЛ и респираторных рецидивирующих инфекций. Int. J. Chron. Препятствовать. Легочная. Dis . 2, 335–345.
PubMed Аннотация | Google Scholar
Калиот, Э., Либон, К., Кернеис, С., и Принга, Э. (2000). Транслокация рибосомного иммуностимулятора через in vitro восстановленный пищеварительный барьер, содержащий М-подобные клетки. Сканд. J. Immunol . 52, 588–594. DOI: 10.1046 / j.1365-3083.2000.00819.x
CrossRef Полный текст | Google Scholar
Капетти А., Коссу М. В., Карензи Л. и Риццардини Г. (2013). Четыре года иммунизации OM-85 BV для профилактики респираторных инфекций у ВИЧ-положительных пациентов.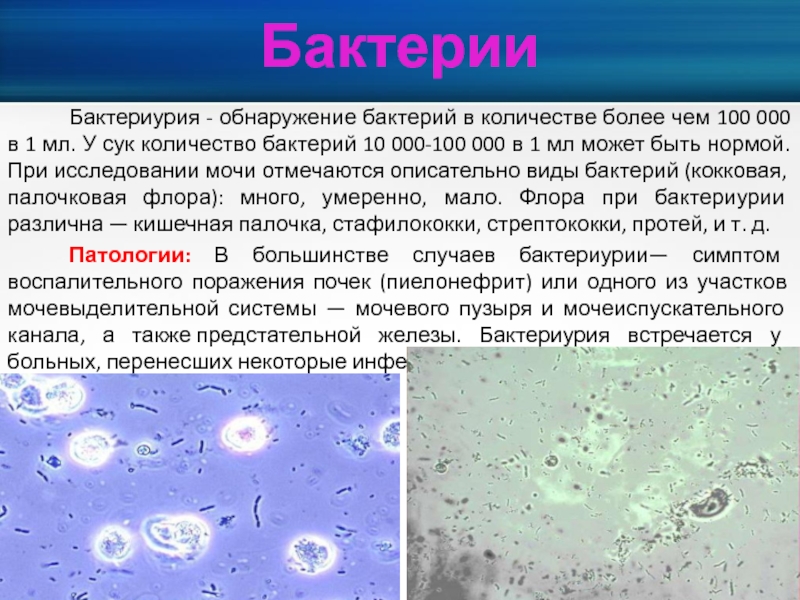 Гум. Вакцины Иммунодер . 9, 1849–1851. DOI: 10.4161 / hv.25104
Гум. Вакцины Иммунодер . 9, 1849–1851. DOI: 10.4161 / hv.25104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каццола, М., Анапурапу, С., и Пейдж, К.П. (2012а). Поливалентный механический бактериальный лизат для профилактики рецидивирующих респираторных инфекций: метаанализ. Легочная. Pharmacol. Ther . 25, 62–68. DOI: 10.1016 / j.pupt.2011.11.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каццола, М., Капуано, А., Роглиани, П., и Матера, М. Г. (2012b). Бактериальные лизаты как потенциально эффективный подход к профилактике обострения ХОБЛ. Curr. Мнение. Pharmacol . 12, 300–308.DOI: 10.1016 / j.coph.2012.01.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каццола, М., Роглиани, П. и Курради, Г. (2008). Бактериальные экстракты для профилактики обострений хронической обструктивной болезни легких: точка зрения. Респир. Мед . 102, 321–327. DOI: 10.1016 / j. rmed.2007.11.002
rmed.2007.11.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чен, Дж., Чжоу, Ю., Не, Дж., Ван, Ю., Чжан, Л., Ши, К., и другие. (2017). Бактериальный лизат для профилактики рецидивов хронического риносинусита у детей. J. Laryngol. Отол . 131, 523–528. DOI: 10.1017 / S0022215117000524
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ковьелло, С., Вимменауэр, В., Полак, Ф. П., и Ируста, П. М. (2014). Бактериальные лизаты улучшают защитный ответ антител против респираторных вирусов через Toll-подобный рецептор 4. Hum. Вакцины Иммунодер . 10, 2896–2902.DOI: 10.4161 / hv.29784
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дель-Рио-Наварро, Б. Э., Эспиноза-Росалес, Ф. Дж., Фленади, В., и Сиенра-Монж, Дж. Дж. Л. (2012). Иммуностимуляторы для профилактики инфекций дыхательных путей у детей. Evid. На основе Child Heal . 7, 629–717. DOI: 10.1002 / ebch.1833
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dussourd d’Hinterland, L. , Normier, G., and Durand, J. (1980). Приготовление субклеточных фракций. Arzneimittel Forschung Drug Res . 30, 126–132.
, Normier, G., and Durand, J. (1980). Приготовление субклеточных фракций. Arzneimittel Forschung Drug Res . 30, 126–132.
PubMed Аннотация | Google Scholar
Эспозито, С., Бьянкини, С., Полинори, И., и Принципи, Н. (2019). Воздействие ОМ-85 на детей с рецидивирующими инфекциями дыхательных путей в течение двух лет подряд: ретроспективное исследование. Int. J. Environ. Res. Общественное здравоохранение 16, 1–8. DOI: 10.3390 / ijerph26061065
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эспозито, С., Маркизио, П., Прада, Э., Далено, К., Порретти, Л., Карсетти, Р. и др. (2014). Влияние смешанного бактериального лизата (OM-85 BV) на иммуногенность, безопасность и переносимость инактивированной вакцины против гриппа у детей с рецидивирующей инфекцией дыхательных путей. Vaccine 32, 2546–2552. DOI: 10.1016 / j.vaccine.2014.03.055
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эспозито С. , Сото-Мартинес М. Э., Фелешко В., Джонс М. Х., Шен К.-Л. и Шаад У.Б. (2018). Неспецифические иммуномодуляторы при рецидивирующих инфекциях дыхательных путей, хрипах и астме у детей. Curr. Мнение. Allergy Clin. Иммунол . 18, 198–209. DOI: 10.1097 / ACI.0000000000000433
, Сото-Мартинес М. Э., Фелешко В., Джонс М. Х., Шен К.-Л. и Шаад У.Б. (2018). Неспецифические иммуномодуляторы при рецидивирующих инфекциях дыхательных путей, хрипах и астме у детей. Curr. Мнение. Allergy Clin. Иммунол . 18, 198–209. DOI: 10.1097 / ACI.0000000000000433
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fiocchi, A., Omboni, S., Mora, R., Macchi, A., Nespoli, L., Arrigoni, S., et al. (2012). Эффективность и безопасность иммуномодулятора на основе рибосом для профилактики рецидивов респираторных инфекций у социализированных детей. Аллергия, астма Proc . 33, 197–204. DOI: 10.2500 / aap.2012.33.3516
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фручано Э. и Борн С. (2007). Фаг как противомикробный агент: еретические теории д’Эреля и их роль в упадке фагопрофилактики на Западе. Кан. J. Infect. Дис. Med. Микробиол . 18, 19–26. DOI: 10.1155 / 2007/976850
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Греверс, Г. , Паласиос, О., Родригес, Б., Абель, С. В., и ван Обель, А. (2000). Лечение рецидивирующих инфекций дыхательных путей поливалентным бактериальным лизатом: результаты открытого проспективного многонационального исследования. Adv. Ther . 17, 103–116. DOI: 10.1007 / BF02854843
, Паласиос, О., Родригес, Б., Абель, С. В., и ван Обель, А. (2000). Лечение рецидивирующих инфекций дыхательных путей поливалентным бактериальным лизатом: результаты открытого проспективного многонационального исследования. Adv. Ther . 17, 103–116. DOI: 10.1007 / BF02854843
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гутьеррес-Таранго, М. Д., и Бербер, А. (2001). Безопасность и эффективность двух курсов OM-85 BV в профилактике инфекций дыхательных путей у детей в течение 12 месяцев. Сундук 119, 1742–1748. DOI: 10.1378 / сундук.119.6.1742
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хэнкок Р. Э. У., Нижник А. и Филпотт Д. Дж. (2012). Модуляция иммунитета как терапия бактериальных инфекций. Nat. Ред. Microbiol . 10, 243–254. DOI: 10.1038 / nrmicro2745
CrossRef Полный текст | Google Scholar
Хубер, М., Краутер, К., Винкельманн, Г., Бауэр, Х. В., Ральфс В. В., Лауэнер, П. А. А. и др.(2000). Иммуностимуляция бактериальными компонентами: II. Исследования эффективности и метаанализ бактериального экстракта OM-89. Int. J. Immunopharmacol . 22, 1103–1111. DOI: 10.1016 / S0192-0561 (00) 00070-9
и др.(2000). Иммуностимуляция бактериальными компонентами: II. Исследования эффективности и метаанализ бактериального экстракта OM-89. Int. J. Immunopharmacol . 22, 1103–1111. DOI: 10.1016 / S0192-0561 (00) 00070-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Illartein, P.-R. (1971). Фармацевтический препарат на основе бактериальных антигенов . Патент США 003608066. Бюро по патентам и товарным знакам США.
Google Scholar
Хара-Перес, Дж.В., Бербер А. (2000). Первичная профилактика острых респираторных инфекций у детей с помощью бактериального иммуностимулятора: двойное замаскированное плацебо-контролируемое клиническое исследование. Clin. Ther . 22, 748–759. DOI: 10.1016 / S0149-2918 (00)
-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кирни, С. К., Дзекевич, М., Фелешко, В. (2015). Иммунорегуляторные и иммуностимулирующие реакции бактериальных лизатов при респираторных инфекциях и астме. Ann. Аллергия, астма, иммунол . 114, 364–369. DOI: 10.1016 / j.anai.2015.02.008
Ann. Аллергия, астма, иммунол . 114, 364–369. DOI: 10.1016 / j.anai.2015.02.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ланзилли, Г., Траггиаи, Э., Брайдо, Ф., Гарелли, В., Фолли, К., Чиаппори, А. и др. (2013). Введение поливалентного механического бактериального лизата пожилым пациентам с ХОБЛ: влияние на циркулирующие Т, В и NK-клетки. Immunol. Lett . 149, 62–67. DOI: 10.1016 / j.imlet.2012.11.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лауэнер П.А. (1994). Бактериальные лизаты и рибосомы как индукторы специфических иммунных ответов: сравнительное исследование. Сканд. J. Immunol . 40, 466–467. DOI: 10.1111 / j.1365-3083.1994.tb03489.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мелиоли Г. и Фасани Р. (2004). Иммуномодулирующая композиция, содержащая фракцию частиц механических лизатов бактерий . WO 2004/096270 A1. Рим: Всемирная организация интеллектуальной собственности.
Google Scholar
Мишель, Ф., Dussourd D’Hinterland, L., Bousquet, J., Pinel, A., and Normier, G. (1978). Иммуностимуляция рибосомной вакциной, связанной с адъювантом бактериальной клеточной стенки, у человека. Заражение. Иммунная . 20, 760–769. DOI: 10.1128 / IAI.20.3.760-769.1978
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мора, Р., Барбьери, М., Пассали, Г., Соватзис, А., Мора, Ф., и Кордоне, М. (2002). Профилактика среднего отита у детей с инфекциями верхних дыхательных путей. Int. J. Pediatr. Оториноларингол . 63, 111–118. DOI: 10.1016 / S0165-5876 (01) 00649-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Наварро, С., Коссалтер, Г., Чиавароли, К., Канда, А., Флери, С., Лаццари, А. и др. (2011). Пероральный прием бактериальных экстрактов предотвращает астму за счет рекрутирования регуляторных Т-клеток в дыхательные пути. Mucosal Immunol. 4, 53–65. DOI: 10,1038 / mi.2010. 51
51
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пан, Л., Цзян, X. Г., Го, Дж., Тянь, Ю., и Лю, К. Т. (2015). Эффекты OM-85 BV у пациентов с хронической обструктивной болезнью легких: систематический обзор и метаанализ. J. Clin. Pharmacol . 55, 1086–1092. DOI: 10.1002 / jcph.518
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пиллих, Дж., И Балкарек, Дж. К. (2011). Состав и методы лечения микробных инфекций . Патент США 008007817B2. Бирмингем, Алабама: Бюро патентов и товарных знаков США.
Google Scholar
Риал, А., Феррара, Ф., Суарес, Н., Скавоне, П., Маркес, Дж. М., и Чабалгоити, Дж. А. (2016). Интраназальное введение поливалентного бактериального лизата вызывает саморегулирующееся воспаление в легких и сигнатуру памяти Th2 / Th27. Микробы заражают . 18, 747–757. DOI: 10.1016 / j.micinf.2016.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Риччи, Р. , Палмеро, К., Базурро, Дж., Риччио, А. М., Гарелли, В., Ди Марко, Э. и др. (2014). Введение поливалентного механического бактериального лизата пожилым пациентам с ХОБЛ приводит к серологическим признакам эффективного иммунного ответа, связанного с уменьшением количества острых эпизодов. Легочная. Pharmacol. Ther . 27, 109–113. DOI: 10.1016 / j.pupt.2013.05.006
, Палмеро, К., Базурро, Дж., Риччио, А. М., Гарелли, В., Ди Марко, Э. и др. (2014). Введение поливалентного механического бактериального лизата пожилым пациентам с ХОБЛ приводит к серологическим признакам эффективного иммунного ответа, связанного с уменьшением количества острых эпизодов. Легочная. Pharmacol. Ther . 27, 109–113. DOI: 10.1016 / j.pupt.2013.05.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Розы А., Черостовска-Вынимко Дж. (2008). Бактериальные иммуностимуляторы — механизм действия и клиническое применение при респираторных заболеваниях. Пневмонол. Алергол. Pol . 76, 353–359.
PubMed Аннотация | Google Scholar
Ruah, S. B., Ruah, C., Van Aubel, A., Abel, S., and Elsasser, U. (2001). Эффективность поливалентного бактериального лизата у детей с рецидивирующими инфекциями дыхательных путей. Adv. Ther . 18, 151–162. DOI: 10.1007 / BF02850109
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шаад, У. Б. (2010). OM-85 BV, иммуностимулятор при рецидивирующих инфекциях дыхательных путей у детей: систематический обзор. Мир Дж. Педиатр . 6, 5–12. DOI: 10.1007 / s12519-010-0001-x
Б. (2010). OM-85 BV, иммуностимулятор при рецидивирующих инфекциях дыхательных путей у детей: систематический обзор. Мир Дж. Педиатр . 6, 5–12. DOI: 10.1007 / s12519-010-0001-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Солер М., Мюттерляйн Р. и Козма Г. (2007). Двойное слепое исследование OM-85 у пациентов с хроническим бронхитом или легкой хронической обструктивной болезнью легких. Дыхание 74, 26–32. DOI: 10.1159 / 000093933
CrossRef Полный текст | Google Scholar
Свендсен, К. Л., и Джонсон, В. (1976). Гуморальный иммунитет к Streptococcus pneumoniae , индуцированный фракцией пневмококковых рибосом. Заражение. Иммунная . 14, 345–354. DOI: 10.1128 / IAI.14.2.345-354.1976
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Танг, Х., Фанг, З., Саборио, Г., и Сю, К. (2015). Эффективность и безопасность ОМ-85 у пациентов с хроническим бронхитом и / или хронической обструктивной болезнью легких. Легкое 193, 513–519. DOI: 10.1007 / s00408-015-9737-3
Легкое 193, 513–519. DOI: 10.1007 / s00408-015-9737-3
CrossRef Полный текст | Google Scholar
Thomas, D. W., and Weiss, E. (1972). Ответ мышей на инъекцию рибосомальной фракции Neisseria meningitidis группы B. Заражение. Иммунная . 6, 355–363. DOI: 10.1128 / IAI.6.3.355-363.1972
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Триантафиллу В., Уоркман А. Д., Патель Н. Н., Майна И. В., Тонг К. С. Л., Куан Е. К. и др. (2019). Растворимые компоненты Бронхо-Ваксом ® (OM-85 BV) стимулируют врожденный иммунитет придаточных пазух носа. Int. Форум Allergy Rhinol . 9, 370–377. DOI: 10.1002 / alr.22276
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тиррелл, Д.А., Нолан, П. С., Рид, С. Е., и Хили, М. Дж. (1972). Испытание орального бактериального антигена против простудных заболеваний. руб. J. Prev. Soc. Мед . 26, 129–131. DOI: 10.1136 / jech.26.2.129
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Веннеман М. Р. и Берри Л. Дж. (1971). Клеточно-опосредованная резистентность, индуцированная иммуногенными препаратами Salmonella typhimurium. Заражение. Иммунная . 4, 381–387. DOI: 10.1128 / IAI.4.4.381-387.1971
Р. и Берри Л. Дж. (1971). Клеточно-опосредованная резистентность, индуцированная иммуногенными препаратами Salmonella typhimurium. Заражение. Иммунная . 4, 381–387. DOI: 10.1128 / IAI.4.4.381-387.1971
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вилла, E., Гарелли В., Брайдо Ф., Мелиоли Г. и Каноника Г. В. (2010). Можно ли усилить естественную защиту человека с помощью лизатов бактерий? World Allergy Org. J . 3 (Приложение 8), S17 – S23. DOI: 10.1186 / 1939-4551-3-S2-S17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ваврисюк, С., Набер, К., Рехбергер, Т., и Миотла, П. (2019). Профилактика и лечение неосложненных инфекций нижних мочевых путей в эпоху роста устойчивости к противомикробным препаратам — неантибиотические подходы: системный обзор. Arch. Гинеколь. Акушерский . 300, 821–828. DOI: 10.1007 / s00404-019-05256-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Венгер, М. Д., ДеФиллипс, П., и Брейсуэлл, Д. Г. (2008). Микромасштабная техника разрушения дрожжевых клеток для комплексных стратегий разработки процессов. Biotechnol. Прог . 24, 606–614. DOI: 10.1021 / bp070359s
Д., ДеФиллипс, П., и Брейсуэлл, Д. Г. (2008). Микромасштабная техника разрушения дрожжевых клеток для комплексных стратегий разработки процессов. Biotechnol. Прог . 24, 606–614. DOI: 10.1021 / bp070359s
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Всемирная организация здравоохранения (2017 г.). 10 основных причин смерти .
Google Scholar
Инь, Дж., Сюй, Б., Цзэн, X., и Шэнь, К. (2018). Бронхо-Ваксом при рецидивирующих инфекциях дыхательных путей у детей: систематический обзор и метаанализ. Int. Иммунофармакол . 54, 198–209. DOI: 10.1016 / j.intimp.2017.10.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Юманс, А.С., Юманс, Г.П. (1965). Иммуногенная активность рибосомной фракции, полученной из Mycobacterium tuberculosis . Дж. Бактериол . 89, 1291–1297. DOI: 10.1128 / JB.89.5.1291-1298.1965
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Загульски О. , Стрек П., Каспрович А. и Бялецка А. (2015). Эффективность поливалентного бактериального лизата и аутовакцины против бактериальной колонизации верхних дыхательных путей потенциальными патогенами: рандомизированное исследование. Med. Sci. Монит . 21, 2997–3002. DOI: 10.12659 / MSM.893779
, Стрек П., Каспрович А. и Бялецка А. (2015). Эффективность поливалентного бактериального лизата и аутовакцины против бактериальной колонизации верхних дыхательных путей потенциальными патогенами: рандомизированное исследование. Med. Sci. Монит . 21, 2997–3002. DOI: 10.12659 / MSM.893779
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Можем ли мы усилить естественную защиту человека с помощью бактериальных лизатов? | Журнал Всемирной организации аллергии
Файл TM: Эпидемиология инфекций дыхательных путей. Semin Respir Infect. 2000, 15: 184-194. Обзор
CAS Статья PubMed Google ученый
Розы А., Чоростовска-Вынимко Дж .: Бактериальные иммуностимуляторы — механизм действия и клиническое применение при респираторных заболеваниях..gif) Пневмонол Алергол Пол. 2008, 76: 353-359. Обзор
Пневмонол Алергол Пол. 2008, 76: 353-359. Обзор
PubMed Google ученый
Collet JP, Shapiro P, Ernst P, Renzi T, Ducruet T., Robinson A: эффекты иммуностимулирующего агента при обострениях и госпитализации у пациентов с хронической обструктивной болезнью легких. Am J Respir Crit Care Med. 1997, 156: 1719-1724.
CAS Статья PubMed Google ученый
Steurer-Stey C, Bachmann LM, Steurer J, TramȲr MR: Устные очищенные бактериальные экстракты при хроническом бронхите и ХОБЛ: систематический обзор.Грудь. 2004, 126: 1645-1655.
Артикул PubMed Google ученый
Schaad UB, Mɒtterlein R, Goffin H: Исследовательская группа BV-Child. Иммуностимуляция OM-85 у детей с рецидивирующими инфекциями верхних дыхательных путей: двойное слепое плацебо-контролируемое многоцентровое исследование. Грудь. 2002, 122: 2042-2049.
Артикул PubMed Google ученый
Росси Г.А., Пери С, Рейнал М.Э., Дефилиппи А.С., Риссо ФМ, Шенон Г., Паллестрини Э, Мелиоли Г.: естественный иммунный ответ против бактерий, обычно участвующих в инфекциях верхних дыхательных путей: анализ антиген-специфических уровней IgA в слюне. Immunol Lett. 2003, 86: 85-91.
CAS Статья PubMed Google ученый
Пауэлс Р., Буист А., Калверли П., Дженкинс С. , Херд СС: Научный комитет GOLD.Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких. Итоги семинара по глобальной инициативе NHLBI / ВОЗ по хронической обструктивной болезни легких (GOLD). Am J Respir Crit Care Med. 2001, 163: 1256-1276.
, Херд СС: Научный комитет GOLD.Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких. Итоги семинара по глобальной инициативе NHLBI / ВОЗ по хронической обструктивной болезни легких (GOLD). Am J Respir Crit Care Med. 2001, 163: 1256-1276.
CAS Статья PubMed Google ученый
Мерфи Т., Сетхи С., Современное состояние: бактериальная инфекция при хронической обструктивной болезни легких. Энн Рев Респир Дис. 1992, 146: 1067-1083.
CAS Статья Google ученый
Braido F, Tarantini F, Ghiglione V, Melioli G, Canonica GW: Бактериальный лизат в профилактике обострения ХОБЛ и респираторных рецидивирующих инфекциях. Int J Chron Obstruct Pulmon Dis. 2007, 2: 335-345.
2007, 2: 335-345.
CAS PubMed PubMed Central Google ученый
Сингх К., Амдекар С., Сингх Д.Д., Трипати П., Шарма Дж., Ядав Х .: Врожденный и специфический кишечный иммунитет и микробное вмешательство.FEMS Immunol Med Microbiol. 2009, 55: 6-12. Epub 2008 декабрь 10. Обзор
Google ученый
Brandtzaeg P: Иммунитет слизистых оболочек: индукция, распространение и эффекторные функции. Scand J Immunol. 2009, 70: 505-515. Обзор
CAS Статья PubMed Google ученый
Канг Ю., Тан Л., Кэрролл М., Джентл М., Сим Р. Б.: Распознавание целевого паттерна белками комплемента классического и альтернативного путей. Adv Exp Med Biol. 2009, 653: 117-128. Обзор
Adv Exp Med Biol. 2009, 653: 117-128. Обзор
CAS Статья PubMed Google ученый
Джу Х, Кларк Дж., Харт Д. Н.: Обзор человеческих подтипов DC. Методы Мол биол. 2010, 595: 3-20. Просмотреть статью
PubMed Google ученый
Kabelitz D, Schrder J-M, (eds): Механизмы защиты эпителия. Chem Immunol Allergy. Базель, Каргер. 2005, 86: I-XII.Авторские права 2005 г. S. Karger AG, Базель (Швейцария)
Fuggetta M, Lanzilli G: Attivazione delle risposte immmunitarie mediante Vacini batterici. Eur Respir News. 2007, 15: 69-77.
Google ученый
Lanzilli G, Falchetti R, Tricarico M, Ungheri D, Fuggetta MP: in vitro эффекты иммуностимулирующего бактериального лизата на функцию лимфоцитов человека. Int J Immunopathol Pharmacol. 2005, 18: 245-254.
CAS Статья PubMed Google ученый
Lanzilli G, Falchetti R, Cottarelli A, Macchi A, Ungheri D, Fuggetta MP: In vivo эффект иммуностимулирующего бактериального лизата на B-лимфоциты человека. Int J Immunopathol Pharmacol. 2006, 19: 551-559.
CAS Статья PubMed Google ученый
Брайдо Ф., Тарантини Ф., Гильоне В., Мелиоли Дж., Каноника Г.В.: Бактериальный лизат в профилактике острого обострения ХОБЛ и респираторных рецидивирующих инфекциях. Int J Chron Obstruct Pulmon Dis. 2007, 2: 335-345.
Int J Chron Obstruct Pulmon Dis. 2007, 2: 335-345.
CAS PubMed PubMed Central Google ученый
Chiavaroli C, Moore A: Гипотеза, связывающая противоположные иммунологические эффекты, вызванные бактериальным лизатом OM-89 при инфекции мочевыводящих путей и ревматоидном артрите. BioDrugs. 2006, 20: 141-149.
CAS Статья PubMed Google ученый
Альянакян М.-А, Грела Ф., Ауменье А. Трансформирующий фактор роста и естественные Т-клетки-киллеры участвуют в защитном эффекте бактериального экстракта при диабете 1 типа. Сахарный диабет. 2006, 55: 179-185.
CAS Статья PubMed Google ученый
Зиуцио С., Саксон Б. Вакцинотерапия при лечении бактериальной аллергии носа и носовых пазух. Виад Лек. 1994, 47: 510-513.
CAS PubMed Google ученый
Banche G, Allizond V, Mandras N, Garzaro M, Cavallo G и др.: Улучшение клинического ответа у пациентов с аллергическим ринитом, получавших пероральный иммуностимулирующий бактериальный лизат: иммунологические эффекты in vivo. Int J Immunopathol Pharmacol. 2007, 20: 129-138.
CAS Статья PubMed Google ученый
Хайнц Б., Шлентер В.В., Кирстен Р., Нельсон К.: Клиническая эффективность Бронхо-Ваксома у взрослых пациентов с хроническим гнойным синуситом — многоцентровое, плацебо-контролируемое, двойное слепое исследование.Int J Clin Pharmacol Ther Toxicol. 1989, 27: 530-534.
CAS PubMed Google ученый
Dughera L, Serra AM, Battaglia E, Tibaudi D, Navino M, Emanuelli G: Острый рецидивирующий дивертикулит можно предотвратить путем перорального приема суспензии полибактериального лизата. Минерва Гастроэнтерол Диетол. 2004, 50: 149-153.
CAS PubMed Google ученый
Би-Фэн Цянь, Tonkonogy SL, Hoentjen F, Dieleman L, Balfour Sartor R: Нарушение регуляции люминальных бактериальных антиген-специфических Т-клеточных ответов и функции антиген-представляющих клеток у трансгенных крыс HLA-B27 с хроническим колитом. Иммунология. 2005, 116: 112-121.
Артикул PubMed PubMed Central Google ученый
Куллберг М., Андерсен Дж., Горелик П.Л., Каспар П., Суэрбаум С. и др.: Индукция колита с помощью клона CD4 + Т-клеток, специфичного для бактериального эпитопа.Proc Natl Acad Sci USA. 2003, 100: 15830-15835. Epub 2003 12 декабря
CAS Статья PubMed PubMed Central Google ученый
Hoentjen F, Welling G, Harmsen HJ, Zhang X, Snart J, et al: Уменьшение колита пребиотиками у трансгенных крыс HLA-B27 связано с изменениями микрофлоры и иммуномодуляцией. Воспаление кишечника. 2005, 11: 977-985.
Артикул PubMed Google ученый
Маринова С., Ненков П., Маркова Р., Николаева С., Костадинова Р., Митов И., Вретенарская М.: Клеточные и гуморальные системные и слизистые иммунные реакции, стимулированные пероральным полибактериальным иммуномодулятором у пациентов с хроническими инфекциями мочевыводящих путей. Int J Immunopathol Pharmacol. 2005, 18: 457-473.
CAS Статья PubMed Google ученый
Neumann C, ZɆnnchen B, Willershausen-Znnchen B: Эффективность перорального иммуностимулятора при лечении пародонтита: пилотное исследование.Eur J Med Res. 1996, 1: 387-392.
CAS PubMed Google ученый
Oehling A, Baena-Cagnani C, Neffen H: Бактериальная иммунотерапия детской бронхиальной астмы. Allergol Immunopathol (Мадр). 1980, 8: 177-184.
CAS Google ученый
Sramek J, Josifko M, Helcl J, Holoubkovȥ E, Janout V, Kozesnȷk B, Macȥovȥ I: Бактериальный лизат (IRS 19), применяемый интраназально для профилактики острых респираторных заболеваний у детей: рандомизированный двойной слепой изучать.J Hyg Epidemiol Microbiol Immunol. 1986, 30: 377-385.
CAS PubMed Google ученый
Zagar S, Lofler-Badzek D: Бронхо-Ваксом у детей с риносинуситом: двойное слепое клиническое испытание. ORL J Otorhinolaryngol Relat Spec. 1989, 50: 397-404.
Артикул Google ученый
Collet JP, Ducruet T, Kramer MS, Haggerty J, Floret D, Chomel J, Durr F: Стимуляция неспецифического иммунитета для снижения риска рецидивирующих инфекций у детей, посещающих детские сады.Исследовательская группа Epicreche. Pediatr Infect Dis J. 1993, 12: 648-652.
CAS Статья PubMed Google ученый
Gomez Barreto D, De la Torre C, Alvarez A, Faure A, Berber A: Безопасность и эффективность OM-85-BV плюс амоксициллин / клавуланат при лечении подострого синусита и профилактике рецидивирующих инфекций в дети. Allergol Immunopathol (Мадр). 1998, 26: 17-22.
CAS Google ученый
Ruah SB, Ruah C, van Aubel A, Abel S, Elsasser U: Эффективность поливалентного бактериального лизата у детей с рецидивирующими инфекциями дыхательных путей. Adv Ther. 2001, 18: 151-162.
CAS Статья PubMed Google ученый
Гутьеррес-Таранго М., Бербер А: Безопасность и эффективность двух курсов OM-85 BV в профилактике инфекций дыхательных путей у детей в течение 12 месяцев. Грудь. 2001, 119: 1742-1748.
CAS Статья PubMed Google ученый
Schaad UB, Mutterlein R, Goffin H, BV-Child Study Group: Иммуностимуляция OM-85 у детей с рецидивирующими инфекциями верхних дыхательных путей: двойное слепое плацебо-контролируемое многоцентровое исследование. Грудь. 2002, 122: 2042-2049.
Артикул PubMed Google ученый
Росашино Ф., Каттанео Л: Стратегии оптимизации соблюдения педиатрических пациентов сезонной антибактериальной вакцинации с сублингвальным введением поливалентных механических бактериальных лизатов (PMBL).Acta Biomed Ateneo Parmense. 2004, 75: 171-178.
Google ученый
Del-Rio-Navarro B, Luis Sienra-Monge JJ, Berber A, Torres-Alcȥntara S, Avila-Castan L, Gmez-Barreto D: Применение OM-85 BV у детей с рецидивирующими респираторными путями инфекции и субнормальные уровни подкласса IgG. Allergol Immunopathol (Мадр). 2003, 31: 7-13.
CAS Статья Google ученый
Хайнц Б., Шлентер В.В., Кирстен Р., Нельсон К.: Клиническая эффективность Бронхо-Ваксома у взрослых пациентов с хроническим гнойным синуситом: многоцентровое плацебо-контролируемое двойное слепое исследование. Int J Clin Pharmacol Ther Toxicol. 1989, 27: 530-534.
CAS PubMed Google ученый
Орсель Б., Делькло Б., Бод М., Деренн Дж. П.: Оральная иммунизация бактериальными экстрактами для защиты от острого бронхита у пожилых пациентов с хроническим бронхитом, помещенных в лечебные учреждения.Eur Respir J. 7: 446-452.
Cvoriscec B, Ustar M, Pardon R, Palecek I, Stipic-Markovic A, Zimic B: Пероральная иммунотерапия хронического бронхита: двойное слепое плацебо-контролируемое многоцентровое исследование. Дыхание. 1989, 55: 129-135.
CAS Статья PubMed Google ученый
Macchi A, Vecchia LD: открытое сравнительное рандомизированное контролируемое клиническое исследование нового иммуностимулирующего бактериального лизата для профилактики инфекций верхних дыхательных путей.Arzneimittelforschung. 2005, 55: 276-281.
CAS PubMed Google ученый
Tricarico D, Varricchio A, D’Ambrosio S, Ascione E, Motta G: Профилактика повторяющихся инфекций верхних дыхательных путей в сообществе монахинь, находящихся в уединении, с помощью нового иммуностимулирующего бактериального лизата. Рандомизированное двойное слепое клиническое исследование. Arzneimittelforschung. 2004, 54: 57-63.
CAS PubMed Google ученый
Мора Р., Барбьери М., Пассали Г.К., Соватзис А., Мора Ф., Кордоне М.П.: профилактическое средство от среднего отита у детей с инфекциями верхних дыхательных путей. Int J Pediatr Otorhinolaryngol. 2002, 63: 111-118.
CAS Статья PubMed Google ученый
Болл П., Тиллотсон Дж., Уилсон Р.: Химиотерапия хронического бронхита. Споры. Presse Med. 1995, 24: 189-194.
CAS PubMed Google ученый
Nicotra M, Kronenberg RS: Против: использование антибиотиков при обострениях хронического бронхита. Semin Respir Infect. 1993, 8: 254-258.
CAS PubMed Google ученый
Isada CM: Pro: антибиотики при хроническом бронхите с обострениями. Semin Respir Infect. 1993, 8: 243-253.
CAS PubMed Google ученый
Деббас Н., Деренн JP: Профилактические эффекты иммуностимулирующего продукта при рецидивирующих инфекциях хронического бронхита у пожилых людей.Легкое. 1990, 168 (Дополнение): 737-740.
Артикул PubMed Google ученый
Колле Дж. П., Шапиро П., Эрнст П., Ренци Т., Дукруэ Т., Робинсон А.: Влияние иммуностимулирующего агента на обострения и госпитализации пациентов с хронической обструктивной болезнью легких. Руководящий комитет исследования и исследовательская группа PARI-IS. Профилактика острой респираторной инфекции с помощью иммуностимулятора. Am J Respir Crit Care Med.1997, 156: 1719-1724.
CAS Статья PubMed Google ученый
Li J, Zheng J, Yuan J, Zeng G, Zhong N, Lin CY: Защитное действие бактериального экстракта против обострения у пациентов с хроническим бронхитом, сопровождающимся хронической обструктивной болезнью легких. Чин Мед Дж (англ.). 2004, 117: 828-834.
Google ученый
Steurer-Stey C, Bachmann L, Steurer, Tramȳr MR: Устные очищенные бактериальные экстракты при хроническом бронхите и ХОБЛ: систематический обзор.Грудь. 2004, 126: 1645-1655.
Артикул PubMed Google ученый
Cazzola M: новый бактериальный лизат защищает, уменьшая инфекционные обострения при умеренной и очень тяжелой ХОБЛ. Двойное слепое рандомизированное плацебо-контролируемое исследование. Тенденции в Мед. 2006, 6: 191-199.
Google ученый
Cazzola M, Noschese P, Di Perna F: Значение добавления поливалентного механического бактериального лизата к терапии пациентов с ХОБЛ при регулярном лечении салметеролом / флутиказоном.Достижения терапии респираторных заболеваний. 2009, 3 (2): 59-63.
Артикул Google ученый
Профилактика инфекций дыхательных путей с помощью бактериального лизата бронхомунала ОМ-85 у детей и взрослых: современное состояние | Междисциплинарная респираторная медицина
Инфекции дыхательных путей (ИРО) представляют собой широко распространенную проблему со здоровьем как у взрослых, так и у детей и влекут за собой высокие экономические затраты во всем мире.На сегодняшний день идентифицированы два основных типа клинически значимых ИРО: острые обострения при хроническом бронхите или хронической обструктивной болезни легких (ХОБЛ) и рецидивирующие инфекции дыхательных путей (ИРО).
ИРО поражают как верхние, так и нижние дыхательные пути и могут быть вызваны широким спектром микроорганизмов. Примитивная причина заболевания обычно вирусная и определяется инфекциями вирусов гриппа и парагриппа, респираторного вируса, аденовируса, риновирусов [1].С другой стороны, рецидивирующие ИРО могут быть вызваны различными типами бактерий, включая Acinetobacter spp ., Chlamydia pneumoniae , Enterobacteriacee , Haemophilusinfluenzae , Legionella pneumophila , Morahalxella Mycoplasma pneumoniae , Nocardia asteroids , Pasteurella multocida , Pseudomonas aeruginosa , Staphylococcus aureus , Stenotrophomonasmaltophilia , Streptococcus pneumoniae и Streptococcus pneumoniae и Streptococcus pneumoniae.
Убедительные данные эпидемиологических исследований показывают, что ИРО на сегодняшний день являются основной причиной заболеваемости и смертности среди детей. Согласно отчету Всемирной организации здравоохранения (ВОЗ) за 1998 год, острые респираторные инфекции нижних дыхательных путей являются причиной 19% всех смертей среди детей в возрасте до 5 лет, и только в 2000 году они стали причиной 1,9 миллиона смертей среди детей (95% ДИ 1,6- 2,2 млн), 70% из которых в Африке и Юго-Восточной Азии [2]. Более того, несколько исследований показали, что такие инфекции возникают чаще, когда они связаны с факторами предрасположенности, такими как воздействие табачного дыма [3], загрязнение воздуха в помещении [4], отсутствие грудного вскармливания [5] и посещение детских садов [ 6].
Частота инфицирования уменьшается на с ростом , но средний уровень инфицирования среди взрослых остается два раза в год. У взрослых наиболее распространенным хроническим респираторным заболеванием является ХОБЛ [7], при котором респираторные вирусы и бактериальные сопутствующие инфекции могут быть обычным явлением [8], а бактериальные инфекции, как сообщается, связаны с 50% обострений [9]. Вирусные инфекции, которые могут вызвать острый бронхит у здоровых людей, являются одной из основных причин обострений у пациентов с ХОБЛ.В прошлом важность вирусных инфекций в этиологии обострений в значительной степени недооценивалась и, вероятно, способствовала плохому результату лечения некоторыми антибиотиками [8].
Одним из традиционных терапевтических подходов к профилактике и лечению ИРО является прием антибиотиков. Однако с годами их эффективность серьезно снизилась (вероятно, из-за частого и неправильного употребления антибиотиков, которое изменило восприимчивость обычных респираторных патогенов к антибиотикам), что снизило пользу для пациента.
В последние годы было четко установлено экономическое бремя ИРО для общества: фармакологические затраты, связанные с облегчением симптомов и предотвращением осложнений, расходы из-за пропущенных дней на работе, поиск помощи у терапевта, госпитализация, родительские отпуск, другие факторы и, конечно, расходы на здравоохранение.
С учетом текущих эпидемиологических и социально-экономических данных, указывающих на необходимость использования альтернативных подходов к антибиотикотерапии, используемых сегодня, целью данного исследования является обсуждение одного из самых традиционных фармакологических вмешательств для лечения ИРТ и ХОБЛ, бактериальных лизатов.В частности, в данной обзорной статье основное внимание будет уделено иммуномодулятору ОМ-85 и его использованию в основных клинических исследованиях, проведенных в последние годы. Также будут представлены результаты основных систематических обзоров.
Иммуномодуляция бактериолизатом ОМ-85
Один из функциональных и безопасных подходов к профилактике и лечению острых (ОРТИ) и рецидивирующих (ИРП) инфекций дыхательных путей — неспецифическое усиление иммунного ответа или усиление врожденных защитных механизмов организма.Это может быть достигнуто с помощью бактериальных лизатов, которые представляют собой смеси бактериальных антигенов, полученных из различных инактивированных патогенных микробов. Антигены получают путем химического или механического лизиса микроорганизмов и их лиофилизированного экстракта, полученного из культивируемых штаммов бактерий, часто присутствующих в дыхательных путях.
OM-85 BronchoMunal® — это бактериальный иммуностимулятор, полученный путем химического лизиса G + и G- микроорганизмов, часто ассоциированных со многими респираторными инфекциями, а именно Haemophilusinfluenzae , Branhamellacatarrhalis , Klebsiellapneumoniae iella32, 900o31 Klebsiellapneumoniae iella , Streptococcus pyogenes , Streptococcus viridans и Staphylococcus aureus .Лиофилизированный экстракт вводится перорально и содержит белки, пептиды и следы жирных кислот сахаров, липоитейхоевых кислот и детоксифицированных липополисахаридов. Педиатрический состав OM-85 содержит 3,5 мг бактериального экстракта, а состав для взрослых 7 мг. Основные этапы, через которые проходит ОМ-85 при поступлении, показаны на рисунке 1.
Рисунок 1Пять этапов, через которые ОМ-85 проходит от приема до выработки антител в слизистых оболочках дыхательных путей. OM-85, в отличие от типичных вакцин, которые вводятся парентерально, вводится перорально — педиатрическая капсула, содержащая 3,5 мг лиофилизированного экстракта и 7 мг для взрослых. В кишечнике лиофилизированные бактерии достигают пейеровских пятен (1). В этой реактивной лимфоидной ткани дендритные клетки примированы, тем самым активируя лимфоциты и Т- и В-клетки, последние из которых будут продуцировать антитела (2). Затем иммунные клетки транспортируются с лимфой в мезентериальные лимфатические узлы для созревания (3).Активированные иммунные клетки достигают слизистой оболочки дыхательных путей (4) и стимулируют врожденную и адаптивную иммунную систему, а также выработку секреторных антител IgA в слизистой оболочке дыхательных путей (5).
Защитные эффекты бактериального OM-85 в основном обусловлены его модулирующей ролью как в клеточных, так и в гуморальных реакциях. В частности, недавние открытия предполагают, что иммунопротекторные эффекты OM-85 опосредованы стимуляцией клеточного ответа Th2 [10] и индукцией синтеза иммуноглобулина (Ig), в основном IgA, B-клетками.
Параллельно своему влиянию на клеточный ответ OM-85 также повышает врожденный иммунитет в легких, стимулируя активность фагоцитов, тем самым увеличивая разрушение вторгающихся патогенов [11].
Были предложены различные механизмы, с помощью которых ОМ-85 стимулирует фагоцитарные клетки. Mauel et al. показали, что бактериальные иммуномодуляторы усиливают респираторный выброс — выработку супероксида и нитрита — альвеолярными макрофагами, тем самым повышая микробицидную и цитолитическую активность [12].Более того, экспериментальные данные показали, что OM-85 увеличивает экспрессию молекул адгезии [13] и что CD-14-независимый путь запускает активацию фагоцитов. Основные механизмы действия OM-85 приведены на рисунке 2.
Рисунок 2Механизм действия OM-85 [ [11] ] . Ig, иммуноглобулин; INF-γ, интерферон γ; ИЛ, интерлейкин; Th2, NO, оксид азота; Т-хелперные клетки типа 1; Th3: вспомогательная Т-клетка 2 типа.
Иммуностимулирующие компоненты OM-85, а именно: порин, муреин и N-концевая часть липопротеина [14], вероятно, активируют врожденную иммунную систему, связывая toll-подобные рецепторы (TLR), и в соответствии с механизмом-зависимым на сигнальный адаптерный белок TLR MyD88 [10, 15, 16].
Доказательства эффективности и безопасности ОМ-85 у детей
Повышение как специфического, так и неспецифического иммунного ответа считается ключевым моментом при лечении ИРТ.
В этом отношении эффективность OM-85 в укреплении иммунной системы и сокращении количества ИРО была исследована в нескольких клинических испытаниях и проанализирована в систематических обзорах (Таблица 1).
Таблица 1 Описание включенных клинических исследований, проведенных на детяхБольшинство рандомизированных двойных слепых плацебо-контролируемых клинических испытаний, проведенных у детей с ИРО, продемонстрировали эффективность и безопасность OM-85.
В 1993 году Collet et al. изучили эффект лечения ОМ-85 у 423 детей дневного ухода (от 6 до 36 месяцев) [17]. В то время как риск ≥ 4 ИРТ в конце периода наблюдения не был значительно ниже в активной группе по сравнению с плацебо, наблюдалось 48% -ное снижение риска появления ≥ 3 эпизодов инфекций верхних дыхательных путей в 3 случаях. -месячный период лечения в обработанной группе.
ИРО часто являются причиной пропуска школьных дней у детей от 6 до 13 лет: в элегантном исследовании Jara-Perez et al.продемонстрировали профилактический эффект ОМ-85 при острых ИРО (ОРВИ) у 200 девочек, живущих в приюте, группы детей, особенно подверженных микробному заражению и, следовательно, ИРОТ [18]. В конце испытания среднее количество ОРТИ в активной группе составляло 1,0 (0,0-3,0, 5-й и 95-й процентиль), тогда как в группе, получавшей плацебо, оно составляло 3,0 (2,0-5,0, 5-й и 95-й процентиль) (p < 0,05). Более того, авторы показали, что лечение ОМ-85 значительно сокращает количество пропущенных учебных дней, курсов антибиотиков и продолжительность заболевания (p <0.001) по сравнению с группой, получавшей плацебо.
Эффективность профилактики ИРО у детей дошкольного и школьного возраста была подтверждена исследованием Gutiérrez-Tarango et al. [19]. В этом исследовании, помимо уменьшения количества и продолжительности ИРО в активной группе по сравнению с плацебо (среднее ± стандартное отклонение: 5,04 ± 1,99 против 8,0 ± 2,55 соответственно), авторы наблюдали значительное снижение количества антибиотиков. курсы (p <0,001 в обоих случаях).
По данным Schaad et al., Лечение OM-85 снижает частоту возникновения ОРТИ также в популяции детей с рецидивирующими ОРВИ в возрасте 3–8 лет.[20]. OM-85 значительно снизил среднюю частоту ИРТ верхних отделов на 16% в активной группе (p <0,05 по сравнению с группой плацебо). Различия между двумя группами увеличились в течение 5-месячного периода лечения и немного уменьшились в течение месяца наблюдения. Снижение ИРТ в верхних отделах в этом исследовании, хотя и значительное, менее выражено, чем сообщалось Jara-Perez et al. И Gutierrez et al. Однако в последних исследованиях участвовали дети, живущие в детском доме [18] и в районе с высоким уровнем загрязнения [19].Эти параметры связаны с высокой восприимчивостью к ИРТ и, опять же, позволяют предположить, что эффективность OM-85 BV более очевидна у пациентов, особенно чувствительных к ИРО.
Несмотря на то, что увеличение частоты обострений, вызванное инфекционными агентами, является важным исходом у детей с хрипом и астмой, оно обычно включается в число критериев исключения в педиатрических клинических испытаниях, и данные по этому вопросу немногочисленны. Однако клиницисты ищут более подходящие методы лечения, особенно в связи с накоплением данных о том, что обратимость тяжелых атопических заболеваний снижается с течением времени от начала [21].Современные методы лечения, включая ингаляционные кортикостероиды, имеют ограниченную эффективность в предотвращении спровоцированных вирусами приступов свистящего дыхания у маленьких детей. Таким образом, у детей с приступами свистящего дыхания, вызванными ИРО, настоятельно необходимы стратегии первичной и вторичной профилактики. Эффективность ОМ-85 для уменьшения приступов свистящего дыхания была протестирована Razi et al. у 75 дошкольников [22]. В этом хорошо проведенном рандомизированном двойном слепом исследовании авторы продемонстрировали снижение на 37,9% количества приступов свистящего дыхания у пролеченных пациентов по сравнению с плацебо (p <0.01), что указывает на то, что OM-85 является эффективной вторичной профилактической стратегией у детей с приступами хрипов, вызванными ИРО, как атопическими, так и нет. Несмотря на то, что результаты клинических исследований OM-85 для предотвращения ИРО у детей с астмой и атопией обнадеживают, необходимы дальнейшие хорошо спланированные рандомизированные исследования астмы.
Предыдущие исследования показали, что OM-85 увеличивает уровни секреторного IgA [23], сывороточного IgA [24], сывороточного IgG и сывороточного IgM [25] у взрослых.
Однако небольшое рандомизированное двойное слепое плацебо-контролируемое клиническое исследование, проведенное у детей с ИРТ [26], интересно показало значительное снижение уровней подкласса IgG4 после лечения OM-85.Поскольку активная роль подкласса IgG4 была продемонстрирована в реакции гиперчувствительности I типа, эти данные, по-видимому, позволяют сделать вывод о том, что дополнительная терапия с помощью ОМ-85 может быть полезной для уменьшения ИДП у детей с аллергическими заболеваниями дыхательных путей.
Антигенный эффект OM-85 был протестирован также на популяции детей с дефицитом IgA, с целью оценить, может ли OM-85 вызывать аутоиммунитет [27]. В этом 4-летнем проспективном исследовании было набрано 63 ребенка с дефицитом IgA, рецидивирующими фебрильными инфекциями и ИРО, и ОМ-85 был введен группе из 37 детей.В конце исследования частота ИРО не различалась в двух группах детей с дефицитом IgA. Однако клинические и лабораторные маркеры аутоиммунитета не наблюдались в группах, получавших и не получавших лечение.
Общий эффект OM-85 BV при лечении ИРТ изучался также в систематических обзорах. В систематическом количественном обзоре 13 клинических испытаний (2721 пациент) с тестированием OM-85 Steurer-Stey et al. обнаружили слабые доказательства в пользу ОМ-85 для профилактики ОРТИ у детей с тенденцией к меньшему количеству инфекций [28].
В 2010 году Schaad [29] выполнил систематический обзор с целью оценки эффективности OM-85 для предотвращения возникновения ИРО у детей. В исследование было включено восемь рандомизированных контролируемых испытаний (дети в возрасте 1–12 лет), и автор показал снижение на 26,2% у пациентов с ИРТ (то есть ≥3 ИРТ). Результаты этого исследования были очень разнородными, вероятно, из-за клинического и методологического разнообразия. Автор указывает, что положительная эффективность ОМ-85 была особенно заметна у детей с высоким риском ИРО.
В своем недавнем обновлении систематического обзора «Иммуностимуляторы для профилактики инфекций дыхательных путей у детей» Del Rio Navarro et al. [30, 31] показали, что среди 35 проанализированных исследований (4 060 участников, <18 лет, не страдающих астмой, аллергией, атопией или хроническими респираторными заболеваниями) в целом наблюдалось снижение ИРО на 40%. Они выдвинули гипотезу о том, что общий эффект снижения заболеваемости ОРТИ зависит от фоновой частоты ОРТИ, и пришли к выводу, что иммуномодуляторы следует назначать только детям с доказанной высокой восприимчивостью к ОРТИ [31].
Количество клинических испытаний, проанализированных только для OM-85, составило 9 (852 участника) с общим эффектом Z = 5,19 (p <0,001).
Истина в том, что оценка степени влияния ОМ-85 на снижение заболеваемости ОРТИ сдерживается расхождениями, часто из-за высокой гетерогенности исследований и низкого или среднего качества испытаний [32, 33] .
Однако на сегодняшний день несколько клинических исследований подтвердили эффективность и безопасность OM-85 BV для профилактики и лечения ИРО у детей с инфекциями различного происхождения.
Доказательства эффективности и безопасности OM-85 RV у взрослых
Швейцарские руководящие принципы указывают на использование иммуномодуляторов среди возможных терапевтических вариантов, указанных для лечения ХОБЛ у взрослых [34]. Более того, было продемонстрировано, что использование иммуностимуляторов является полезным вариантом лечения ХОБЛ в соответствии с недавней рекомендацией Глобальной инициативы по хронической обструктивной болезни легких (GOLD), совместной ВОЗ и Национальным институтом сердца, легких и крови (NHLBI) [ 35].Однако рекомендуются дополнительные рандомизированные клинические исследования для включения иммуностимуляторов в качестве регулярной терапии у пациентов с ХОБЛ.
Хронический бронхит признан основным источником заболеваемости пожилых пациентов, которые часто страдают рецидивирующими инфекциями дыхательных путей. Эффективность ОМ-85 в профилактике ИРО у пожилых пациентов была продемонстрирована в нескольких клинических исследованиях, как показано в таблице 2.
Таблица 2 Описание клинических исследований, проведенных среди взрослого населенияOrcel et al.оценили эффект OM-85 в рандомизированном контролируемом клиническом исследовании с участием 290 пожилых людей, проживающих в учреждении [36]. Введение бактериального лизата было связано с 28% уменьшением числа пациентов с более низкими ИРТ (p <0,05), что было связано с уменьшением количества эпизодов острого бронхита на 40% (p <0,01). Авторы также наблюдали общее сокращение назначений антибиотиков в группе лечения по сравнению с группой плацебо.
В соответствии с результатами Orcel et al.сокращение продолжительности острых эпизодов бронхита и лихорадки ранее наблюдалось Cvoriscec et al. в рандомизированном клиническом исследовании [24]. Также в этом случае лечение ОМ-85 значительно сократило продолжительность острых эпизодов бронхита (p <0,001) и потребление антибиотиков (p <0,05). Интересно, что в дополнение к клинической эффективности авторы сообщили о значительном увеличении сывороточных уровней IgA и количества Т-лимфоцитов у пациентов, получавших ОМ-85, в течение 3 месяцев после обострения, тем самым подтверждая модулирующую роль ОМ-85 в иммунная система.
Профилактическая роль ОМ-85 в уменьшении обострений у пожилых пациентов с хроническим бронхитом и ХОБЛ была подтверждена в нескольких клинических исследованиях. Collet et al. [37] изучали 191 пожилого человека с хроническим бронхитом и ХОБЛ и сообщили о снижении на 55% количества дней госпитализации и продолжительности пребывания в активной группе по сравнению с плацебо (p = 0,037).
В небольшом более позднем исследовании [38] 90 пациентов с ХОБЛ были рандомизированы для получения OM-85 или плацебо. В конце годичного наблюдения у пролеченных пациентов наблюдалось значительное снижение частоты, продолжительности и тяжести обострения по сравнению с группой плацебо (p <0.05 во всех случаях).
Эффективность этого иммуномодулирующего агента подтверждена Solèr et al. [39] у более молодого населения с легкой формой ХОБЛ или хроническим бронхитом. Авторы сообщили о значительно более высокой вероятности того, что пациенты, получавшие OM-85, не будут иметь обострений (p = 0,014). В частности, эффект от лечения был более значительным среди пациентов, страдающих 2 или более эпизодами обострения с момента включения в исследование, или среди курильщиков (p = 0.001).
В недавнем исследовании 384 пациента, страдающих хроническим бронхитом и ХОБЛ, были вовлечены в рандомизированное контролируемое исследование, в котором сравнивали OM-85 с плацебо при обострениях [40]. По окончании исследования частота повторных обострений в активной группе значительно снизилась (23% по сравнению с 33% в группе плацебо, p <0,05). Более того, результаты показали, что среди пациентов с обострениями количество пациентов с рецидивирующими обострениями было ниже в группе OM-85, чем в группе плацебо (38.7 против 73,1, p <0,01), и что процент введения антибиотиков был ниже в группе лечения по сравнению с группой плацебо (37,0% против 63%, p <0,05).
Эффект OM-85 был протестирован также на группе ВИЧ-положительных пациентов, группе пациентов, для которых активно проводится поиск иммуностимулирующих методов лечения. Эти пациенты имеют высокую распространенность ХОБЛ [41] и имеют высокий риск развития сезонных ИРО. В этом пилотном исследовании приняли участие 130 ВИЧ-инфицированных пациентов с высоким риском ИРО [42].ОМ-85 вводили 65 пациентам в течение первого года. Ввиду удовлетворительных результатов, полученных у этих пациентов, в следующем году лечение было распространено на всех пациентов. Было проведено сравнение количества событий в год до введения и в год после введения, в результате чего было уменьшено количество циклов антибиотиков (которое уменьшилось с 297 до 55) и госпитализаций (которое уменьшилось с 23 до 6).
Эффект орально очищенных бактериальных лизатов при хроническом бронхите и ХОБЛ был проанализирован в двух недавних систематических обзорах [28, 43].Steurer-Stey et al. проанализировали 13 исследований, в которых участвовал 1971 пациент, получавший бактериальные экстракты или плацебо [28]. Авторы не нашли достаточно доказательств, чтобы предположить, что лечение может предотвратить обострения. Однако лечение OM-85 BV привело к улучшению симптомов по оценке как наблюдателей, так и пациентов, а также к сокращению средней продолжительности обострения. В другом системном обзоре Sprenkle et al. оценили эффект и безопасность OM-85 у пациентов с ХОБЛ [43]. Авторы изучили 13 рандомизированных контролируемых испытаний с участием 2066 пациентов и обнаружили незначительную тенденцию в пользу OM-85 в снижении частоты обострений, даже если профиль безопасности был хорошим.Этот результат может быть связан с высокой разнородностью данных и методологическими недостатками некоторых испытаний. Следовательно, необходимы дальнейшие более крупные высококачественные рандомизированные контролируемые испытания с участием субъектов с четко выраженной ХОБЛ для подтверждения эффективности этого агента.
Бактериальные лизатные препараты для респираторных заболеваний, которые должны использоваться только для профилактики рецидивирующих инфекций
EMA рекомендует, чтобы бактериальные лизатные препараты, разрешенные для респираторных заболеваний, использовались только для профилактики рецидивирующих респираторных инфекций, за исключением пневмонии.Это следует за обзором, в котором сделан вывод об отсутствии надежных данных, показывающих, что эти лекарства эффективны при лечении существующих респираторных инфекций или для профилактики пневмонии, поэтому их не следует использовать для этих целей.
В обзоре комитет EMA по лекарственным средствам для человека (CHMP) рассмотрел результаты клинических исследований, данные о побочных эффектах этих лекарств и рекомендации группы экспертов по инфекционным заболеваниям.
Хотя данные ограничены, обзор обнаружил некоторые доказательства эффективности этих лекарств в профилактике рецидивирующих инфекций дыхательных путей, а профиль безопасности соответствует тому, что ожидается для этого типа продукта.Таким образом, CHMP рекомендовал продолжить использование лекарств для профилактики, но компании должны предоставить дополнительные данные о безопасности и эффективности из новых клинических исследований к 2026 году.
Информация для пациентов
- Бактериальные лизатные лекарства не должны использоваться для лечить существующие инфекции дыхательных путей или предотвращать пневмонию (инфекцию легких), потому что недостаточно данных, чтобы показать, что они работают для этих целей.
- Бактериальные лизаты можно продолжать использовать для предотвращения рецидива инфекций дыхательных путей (кроме пневмонии) у пациентов, которые регулярно переносят инфекции.
- Если у вас есть инфекция и вы принимаете бактериальный лизат для ее лечения, или если вы принимаете одно из этих лекарств для предотвращения пневмонии, обратитесь к врачу или фармацевту за советом об альтернативных вариантах.
- Если у вас есть какие-либо вопросы или опасения по поводу вашего лекарства, обсудите их со своим врачом или фармацевтом.
Информация для медицинских работников
- Показания к применению бактериальных лизатов ограничиваются профилактикой рецидивирующих инфекций дыхательных путей, за исключением пневмонии.Бактериальные лизаты не следует назначать для лечения существующих респираторных инфекций или для профилактики пневмонии из-за отсутствия данных об эффективности.
- Информация о назначении лекарств будет обновлена с новым показанием и предупреждением против использования для профилактики пневмонии.
Подробнее о лекарствах
Бактериальные лизатные препараты производятся из бактериальных клеток, которые расщепляются и предназначены для стимуляции иммунной системы для распознавания и борьбы с инфекциями.Эти лекарства принимают внутрь (в виде капсул, таблеток, гранул / порошка для приготовления пероральной смеси или капель), растворяют под языком (в виде таблеток), вдыхают через нос (в виде жидкости) или вводят путем инъекции в мышцу. или под кожей.
Лекарства, содержащие бактериальные лизаты, были разрешены в соответствии с национальными процедурами. Они доступны в Австрии, Бельгии, Болгарии, Чехии, Германии, Греции, Венгрии, Италии, Латвии, Литве, Люксембурге, Мальте, Польше, Португалии, Румынии, Словакии и Словении.Они продаются под несколькими торговыми марками, включая Broncho Munal, Broncho Vaxom, Buccalin, Immubron, Immucytal, Ismigen, Lantigen B, Luivac, Ommunal, Paspat, Pir-05, Polyvaccinum, Provax, Respivax и Ribomunyl.
Подробнее о процедуре
Пересмотр лекарственных средств с бактериальным лизатом был начат 28 июня 2018 года по запросу Италии в соответствии со статьей 31 Директивы 2001/83 / ЕС.
Обзор был проведен Комитетом по лекарственным средствам для человека (CHMP), отвечающим за вопросы, касающиеся лекарств для человека, который принял мнение Агентства.Заключение CHMP будет направлено в Европейскую комиссию, которая примет окончательное юридически обязательное решение, применимое во всех странах-членах ЕС.
Бактериальная лизатотерапия для профилактики эпизодов свистящего дыхания и обострений астмы: систематический обзор и метаанализ
Резюме
Свистящее дыхание и астма — все более частые причины заболеваемости у детей и взрослых. Лечение направлено на предупреждение обострений заболевания и сохранение функции легких. Респираторные вирусы составляют около 40–60% обострений.Бактериальные лизаты предотвращают повторные инфекции дыхательных путей и могут уменьшить обострения. Более того, иммуномодулирующие эффекты наблюдались в исследованиях на людях и животных.
Здесь мы стремились оценить влияние терапии бактериальным лизатом на эпизоды хрипов в дошкольном возрасте и частоту обострений астмы. Мы выполнили систематический обзор литературы на основе заявления «Предпочтительные элементы отчетности для систематических обзоров и метаанализа» (PRISMA) и метаанализа с использованием Cochrane Review Manager.Из полученных статей за 2016 год было включено 22 исследования, из которых пять предоставили достаточно данных для метаанализа.
Использование бактериальных лизатов показало уменьшение как эпизодов свистящего дыхания (средняя разница −2,35 (−3,03– −1,67), p <0,001), так и обострений астмы у детей (средняя разница −0,90 (−1,23–0,57), p <0,001). Кроме того, было сокращено использование антибиотиков, а также уменьшилась продолжительность эпизодов хрипов. В настоящее время нет данных по взрослым, страдающим астмой. Иммуномодулирующий эффект, по-видимому, зависит от повышенной активации Т-хелперных (Th) 1-клеток и подавления Th3-клеток.
Эти благоприятные эффекты бактериальных лизатов показывают, что они являются многообещающими в качестве дополнительной терапии при дошкольном хрипе и детской астме.
Реферат
Бактериальные лизаты снижают количество инфекций дыхательных путей за счет иммуномодуляции; мы приводим доказательства предотвращения приступов хрипов и обострений астмы с помощью бактериальных лизатов. Таким образом, они могут быть многообещающим дополнительным средством лечения астмы. https://bit.ly/3dunDLG
Введение
Около 9% детей и взрослых в Европе страдают астмой [1].Что еще более важно, астма и особенно обострения астмы становятся все более частой причиной заболеваемости среди детей и взрослых [2, 3]. Ранние стадии астмы включают хрипы дошкольного возраста, которым страдают до 10–30% детей. Около 15–25% детей испытывают периодические хрипы до школьного возраста [4].
Свистящее дыхание Заболевания нижних дыхательных путей у младенцев и детей ясельного возраста обычно изначально вызваны вирусными инфекциями дыхательных путей (ИРО) и связаны с высоким уровнем воспаления и ремоделированием дыхательных путей [5].Рецидивирующие хрипы могут значительно повысить риск развития стойких хрипов или астмы в более позднем возрасте, что окажет необратимое влияние на функцию легких. Риск может еще больше увеличиваться, если он связан с ранней сенсибилизацией к аэроаллергенам [6]. Текущие варианты лечения хрипов дошкольного возраста кажутся неудовлетворительными. Недавнее международное исследование выявило общее разочарование существующими диагностическими средствами и недостаточными вариантами лечения [7].
Обострения астмы определяются как острое или подострое ухудшение симптомов по сравнению с обычным состоянием пациента и лечатся пероральными кортикостероидами и в некоторых случаях антибиотиками.Обострения в основном вызваны аллергическими стимулами и ИРО, последние составляют около 40–60 обострений [8]. Профилактика обострения чаще всего достигается за счет улучшения соблюдения режима терапии и изменения образа жизни [9–11]. Тем не менее, у пациентов с тяжелой эозинофильной и аллергической астмой моноклональные антитела, нацеленные на воспалительные пути иммуноглобулина (Ig) E, интерлейкина (IL) -4 и IL-5, являются важной стратегией лечения для предотвращения обострения. За исключением мер гигиены и здорового образа жизни, нет широко доступной специфической противовирусной терапии для предотвращения вирусных ИРО [12–15].В этом контексте неудовлетворенных потребностей усиление иммунного ответа хозяина против вирусных инфекций с помощью иммуномодуляторов может предложить новый профилактический подход.
Учитывая, что большинство респираторных заболеваний со свистящим дыханием, а также обострений астмы начинаются в верхних дыхательных путях, вероятно, что эффективной стратегией снижения риска обострений астмы может быть профилактика верхних ИРТ, включая простуду. Несколько исследований показывают, что в этой области эффективны вакцинации или неспецифические иммуномодуляторы [16].
С начала 1950-х годов пероральные неспецифические препараты бактериального происхождения (бактериальные лизаты или иммуномодуляторы) использовались в Европе и Азии для профилактики рецидивов ИРО [8, 12, 13]. Бактериальные лизаты состоят из инактивированных бактериальных экстрактов патогенных респираторных бактерий [5] и относительно безопасны без сообщений о связанных с ними серьезных побочных эффектах. Бактериальные антигены, используемые в этих лизатах, в основном получают либо химическим (поливалентный химический бактериальный лизат (PCBL)), либо механическим (поливалентный механический бактериальный лизат (PMBL)) клеточным лизисом культур бактериальных штаммов с последующей лиофилизацией [13, 15, 17, 18 ].
Способность бактериальных лизатов предотвращать ИРО была показана в нескольких исследованиях на животных. Исследования на мышах показывают защитный эффект против гриппа и бактериальной суперинфекции после введения бактериального лизата [19]. У людей снижение ИРТ на 30-40% с помощью бактериальных лизатов было оценено в двух метаанализах [16, 20]. Их иммуномодулирующая активность в основном основана на активации дендритных клеток через ядерный фактор-κB и пути митоген-активируемой протеинкиназы [21].Эта активация приводит к стимуляции противовирусного ответа за счет его воздействия на продукцию противовирусных цитокинов, включая интерфероны (IFN), классические Т-хелперные (Th) 1 цитокины и (местные) Ig [18, 19, 22, 23]. Эти изменения Igs сопровождаются повышенной секрецией фактора активации В-клеток [21]. Тем не менее, точный механизм работы, а также потенциальные биомаркеры еще полностью не раскрыты.
Хотя большинство опубликованных исследований бактериальных лизатов при хрипах и астме кажутся многообещающими, они различаются по характеристикам пациентов, количеству и применяемым методам.Поэтому мы стремились систематически оценивать клинические и иммунологические эффекты бактериальных лизатов в качестве дополнительной терапии для предотвращения эпизодов свистящего дыхания и обострений астмы у детей, подростков и взрослых.
Методы
Настоящий обзор и метаанализ соответствуют утверждениям «Предпочтительные элементы отчетности для систематических обзоров и метаанализа» (PRISMA) [24] и были зарегистрированы в PROSPERO (www.crd.york.ac.uk/prospero CRD42017078141) [25]. Мета-анализ проводился с использованием Revman 5.3 [26].
Embase, Medline, Cochrane и Web of Science искали с момента создания до конца сентября 2019 г. Исследования, в которых отсутствовали доступные аннотации на английском, немецком или французском языках, были исключены из этого поиска. Условия поиска можно найти на дополнительном рисунке.
Результаты поиска были расширены за счет обширного ручного поиска, а недавно представленные тезисы были проверены на соответствие критериям. Отбор статей для дальнейшего анализа был основан на следующих критериях включения: 1) люди с астмой и / или хрипами дошкольного возраста; 2) исследования на животных / лабораторные исследования на моделях астмы; и 3) бактериальные лизаты в качестве вмешательства.Руководящие документы по управлению, протоколы исследований и исследования ХОБЛ были исключены. Все данные были независимо извлечены парами исследователей (G.M. de Boer, J. ółkiewicz и M. Ruszczyński) и подверглись процедуре тройной перекрестной ссылки с использованием стандартизированного протокола и формы для извлечения данных. Впоследствии риск систематической ошибки во всех включенных исследованиях оценивался с помощью Кокрановского инструмента оценки риска систематической ошибки. Разногласия были разрешены после консультации с тремя другими исследователями (G.J. Braunstahl, G.А. Трампер-Страндерс и В. Фелешко).
Данные были извлечены из всех отобранных статей, независимо от того, были ли результаты положительными или отрицательными, чтобы представить справедливую и беспристрастную оценку имеющихся опубликованных доказательств.
Согласно Кокрановскому справочнику, все данные были количественно оценены с использованием средних различий и стандартизованных средних различий с 95% доверительными интервалами и были объединены с использованием модели случайных эффектов, поскольку гетерогенность между исследованиями была высокой.
Статистическая неоднородность была устранена с использованием статистики I 2 (p <0.05 считается значительным), а также путем визуального осмотра участков L'Abbé и определяется как низкий, средний или высокий (I 2 ≤25%, 26 – ≤50% и> 50%, соответственно) [27].
Анализ чувствительности проводился путем тщательного рассмотрения и исключения одного исследования на анализ для определения потенциальной причины. Чтобы изучить потенциальный источник гетерогенности, мы совместно выполнили заранее запланированный анализ, основанный на использовании бактериальных лизатов: PMBL против PCBL.
Показатели исхода
Первичным критерием оценки была разница в эпизодах свистящего дыхания и частоте обострений астмы после использования бактериальных лизатов.Вторичными измерениями результатов были: 1) время до первого эпизода свистящего дыхания / обострения астмы; 2) контроль астмы; 3) продолжительность приступов хрипов / обострения астмы в днях; 4) продолжительность лечения антибиотиками в днях; 5) дни госпитализации; и 6) иммунологические эффекты бактериальных лизатов.
Характеристики бактериальных лизатов, использованных во включенных исследованиях
Бактериальные лизаты, используемые в клинических исследованиях, как правило, представляют собой PMBL и PCBL. Все бактериальные лизаты, кроме MV130, содержат лизаты следующих патогенов: 1) Haemophilus influenzae ; 2) Streptococcus pneumoniae, S.pyogenes и стрептококки viridans; 3) Klebsiella pneumoniae и K. ozaenae ; 4) Staphylococcus aureus ; и 5) Moraxella catarrhalis [28, 29] . В MV310 отсутствуют некоторые подтипы Streptococcus и Klebsiella .
PCBL
OM-85 был единственным PCBL, использованным во включенных исследованиях. Он известен под несколькими торговыми марками, включая Бронхо-Ваксом, ОМ-85БВ, Бронхо-Мунал, Оммунал, Имоккур, Ваксорал и Паксорал. Бактерии культивируют партиями, инактивируют нагреванием и подвергают щелочному лизису после сбора.Лизаты этих 21 бактерии смешивают и лиофилизируют. OM-85 принимают внутрь, запивая небольшим количеством жидкости. Препарат выпускается в двух лекарственных формах: капсулы 7,0 мг для взрослых и капсулы или саше 3,5 мг для детей [28].
PMBL
Ismigen и MV130 были PMBL, использованными во включенных исследованиях. Исмиген также известен как Иммуброн, Бромунил, Респиброн и Бактовакс. Таблетки принимают сублингвально натощак. Препарат выпускается в сублингвальной таблетке по 10 мг для взрослых и детей [29].MV130 известен под торговым наименованием Bactek. Это суспензия, которую ежедневно распыляют сублингвально [14].
Результаты
Поиск
В ходе первоначального поиска в электронных базах данных было обнаружено 2016 записей (рисунок 1). Четыре дополнительных исследования были определены из недавно представленных тезисов на различных встречах. После просмотра 46 статей были детально рассмотрены. Наконец, в этот обзор были включены 22 оригинальных исследования, из которых пять клинических исследований по поводу хрипов в дошкольном возрасте, пять клинических исследований по астме и 12 лабораторных исследований. Одно исследование включало пациентов с ХОБЛ, астмой и аллергическим ринитом, в котором использовалась модель «пациент – контроль». В этом обзоре мы проанализировали только пациентов с астмой, участвовавших в этом исследовании [30].
РИСУНОК 1Блок-схема включенных исследований.
Характеристики исследования
Из 10 клинических исследований, включенных в этот систематический обзор, пять исследований были исключены из метаанализа по следующим причинам: 1) отсутствие числовых данных [31]; 2) нет точно определенных конечных точек [32]; 3) отсутствие средств и числовых данных [33]; 4) данных было недостаточно для анализа [34]; 5) анализ астмы в подгруппах не проводился [30].Всего в этот систематический обзор было включено 778 уникальных пациентов, а 450 — в метаанализ (таблица 1) [29, 30, 32, 35, 36]. Возрастной диапазон при включении составлял от 3 месяцев до 65 лет. Во всех исследованиях бактериальные лизаты сравнивали со стандартным лечением или плацебо. Продолжительность наблюдения составила от 3 до 12 месяцев. Общее качество включенных в метаанализ исследований было промежуточным (рисунок 2). Не все исследования были рандомизированными клиническими испытаниями (РКИ), и не все РКИ были слепыми; большинству из них не хватало ослепляющей информации.Также в большинстве исследований не учитывались сезонные изменения. Число участников варьировалось от 28 до 172.
ТАБЛИЦА 1Обзор характеристик включенных исследований
РИСУНОК 2Bias включал рандомизированные контролируемые испытания для метаанализа.
Все исследования включали только пациентов с отличной приверженностью. Не во всех исследованиях описано, как контролировалось соблюдение режима лечения.
Первичный результат: частота обострений после дополнительной терапии бактериальным лизатом
Эпизоды свистящего дыхания
В пяти исследованиях сообщалось о значительном снижении количества эпизодов свистящего дыхания у младенцев после использования бактериального лизата (таблица 1) [31–33, 36, 37].В четырех исследованиях сообщалось о вторичной профилактике после эпизодов свистящего дыхания [31, 32, 36, 37]. Первичная профилактика свистящего дыхания у очень маленьких детей (в возрасте 3–9 месяцев) с риском атопии была показана в недавнем исследовании [33]. В таблице 1 представлены обширные данные о результатах этих исследований.
Анализ чувствительности, основанный на определении исхода свистящего дыхания и представленных результатах, показал, что только два исследования подходили для метаанализа [36, 37]. Объединенный анализ привел к средней разнице -2.35 эпизодов свистящего дыхания (95% ДИ −3,03– −1,67, p <0,001) с низкой гетерогенностью (I 2 = 0%, p = 0,65) (рисунок 3a). Стандартизованная средняя разница составила -0,96 (95% ДИ -1,26-0,66), p <0,001.
РИСУНОК 3a) Мета-анализ эпизодов свистящего дыхания и обострений астмы. б) Мета-анализ поливалентного химического бактериального лизата (PCBL) и поливалентного механического бактериального лизата (PMBL). BL: бактериальный лизат.
Обострения астмы
В пяти исследованиях сообщалось о снижении частоты обострений после использования бактериального лизата при астме [29, 30, 35, 38, 39].В основном изучались школьники и подростки, и только в одном проекте изучались взрослые, страдающие астмой. Во всех исследованиях сообщалось о значительном уменьшении обострений астмы в течение периода исследования (таблица 1).
Анализ чувствительности, основанный на определении исхода обострения астмы, возрасте участников и представленных результатах, показал, что для метаанализа подходят три исследования [29, 35, 38]. Объединенный анализ показал среднюю разницу в -0,90 обострений за тот же период времени в пользу бактериального лизата (95% ДИ -1.23–0,57, p <0,001) с низкой неоднородностью (I 2 = 0%, p = 0,78) и стандартизованной средней разницей -0,68 (95% ДИ -0,99–0,36, p≤0,001) (рисунок 3a ).
PCBL
в сравнении с PMBLЧто касается возможных различий между PCBL и PMBL, был проведен объединенный анализ для исследований PCBL и PMBL. Было выявлено преимущество использования PCBL для предотвращения обострений астмы и эпизодов свистящего дыхания при средней разнице -1,31 эпизода (95% ДИ -2.00–0,62, p <0,001) с высокой неоднородностью. Объединенный анализ PMBL показал сопоставимые, но незначимые результаты со средней разницей -1,60 эпизода (95% ДИ -3,27–0,06, p = 0,06) (рисунок 3b).
Вторичные конечные точки
Время до первого эпизода / обострения свистящего дыхания
Время до первого эпизода свистящего дыхания увеличивается при введении бактериального лизата [33, 37]. Конеджеро и др. . [37] описали увеличение времени до первого эпизода свистящего дыхания, в среднем на 41 день против 5 дней с использованием MV130 по сравнению с плацебо (HR 0.45, 95% ДИ 0,30–0,67, p <0,005). Хитрый и др. . [33] описали увеличение времени до первого эпизода свистящего дыхания у очень маленьких детей в пользу OM-85 (медиана (IQR) 442,0 (853,0–124,0) дней против 85,0 (386,0–54,0) дней, p = 0,006) для группа плацебо.
Не наблюдалось увеличения времени до первого обострения астмы. Однако Emeryk et al. [29] описал увеличение времени до второго и третьего обострения на 55% (ОР 0,45, 95% ДИ 0,25–0,77, p = 0.002) и на 74% (HR 0,26, 95% ДИ 0,12–0,58, p < 0 . 001) при введении Ismigen.
Контроль заболеваний
Conejero et al . [37] сообщили о меньшем количестве общих симптомов хрипов у детей во время приступов хрипов и в ходе всего исследования (p <0,005 для обоих). Эмерик и др. . [29] не сообщили о значительном улучшении результатов контрольных тестов на астму через 4, 6 и 9 месяцев (среднее значение 5,4 против 5,6, p = 0,69).
Дни свистящего дыхания у детей дошкольного возраста
Исследования, в которых сообщается о продолжительности симптомов, сообщают об уменьшении числа дней свистящего дыхания в пользу использования бактериального лизата.Рази и др. [36] показал среднюю разницу в -22,42 дня свистящего дыхания (p <0,001) на пациента в пользу использования бактериального лизата в период наблюдения 12 месяцев. Кроме того, Han et al. [32] сообщил о разнице в 5,7 «астматических» дней (10,2 ± 1,4 против 4,5 ± 0,9 (p = 0,32)) в пользу использования бактериального лизата. Аналогичным образом, Conejero et al . [37] обнаружили уменьшение количества дней свистящего дыхания на 6,0 против 7,9 в пользу использования бактериального лизата.
Использование антибиотиков
Потребление антибиотиков при обострениях астмы сократилось на 3.8 дней у школьников в одном исследовании (p <0,01) [35].
Неблагоприятные события
Во всех комбинированных исследованиях о нежелательных явлениях сообщалось 172 раза; 85 раз для бактериальных лизатов и 87 раз для плацебо или стандартной терапии. Чаще всего сообщалось о насморке и дискомфорте в животе [29, 30, 32, 33, 35–37].
Иммунологические эффекты бактериальных лизатов
Иммунологические исследования бактериальных лизатов при астме были выполнены с OM-85, за исключением одного, в котором использовался MV130.В шести исследованиях сообщалось об иммунологических результатах введения in vivo бактериального лизата животным [22, 23, 40–43]. OM-85 вводили через питьевую воду или через желудочный зонд моделям мышей или крыс с астмой, сенсибилизированных интраназальной или внутрибрюшинной инъекцией овальбумина. Введение ОМ-85 приводило к уменьшению количества лимфоцитов, эозинофилов, макрофагов и эотаксина, ИЛ-4, ИЛ-5 и ИЛ-13 и увеличению ИФН-гамма в жидкости бронхоальвеолярного лаважа этих животных [22, 23, 40–43 ].Интересно, что уровень регуляторного цитокина IL-10 снижался или повышался при введении бактериального лизата in vivo [22, 43]. Повышенная регуляция CD86 на резидентных дендритных клетках дыхательных путей и увеличение регуляторных Т-клеток (Treg) FoxP3 pos измеряли в образцах дыхательных путей и крови [22, 23]. Было показано, что преобразование FoxP3 neg в Tregs FoxP3 pos управляется дендритными клетками CD103 pos . Более того, частота секретирующих IL-10 клеток в трахее увеличивалась после лечения OM-85, а Т-клетки CD4 pos из трахеи мышей, обработанных бактериальным лизатом, обеспечивали защиту от воспаления дыхательных путей в экспериментах по адоптивному переносу [22] .Эта защита, скорее всего, опосредована подмножеством CCR9 pos FoxP3 pos Treg. Эти клетки, вероятно, имели кишечное происхождение, потому что только дендритные клетки из брыжеечных лимфатических узлов или пейеровских бляшек, как полагают, обладают способностью накладывать CCR9 на лимфоциты. Взятые вместе, эти находки согласуются с моделью, в которой бактериальный лизат способствует развитию Tregs CCR9 pos FoxP3 pos Tregs в мезентериальных лимфатических узлах и что эти клетки впоследствии мигрируют в дыхательные пути и обеспечивают защиту [22].Считается, что эти критические иммунологические изменения ответственны за наблюдаемую менее тяжелую гиперреактивность дыхательных путей в моделях на животных и улучшенную защиту от воспаления дыхательных путей у животных, получавших OM-85 [22, 23, 42]. Кроме того, после введения OM-85 было описано уменьшение толщины стенки дыхательных путей и стеноза просвета у мышей [42].
В девяти исследованиях сообщалось об иммунологических результатах исследований с участием человека: семь исследований in vivo и два исследования in vitro [14, 30, 35, 44–47].
Исследования in vitro показывают индукцию IL-6, IL-8 и фактора некроза опухоли (TNF) -α в фибробластах легких человека, стимулированных OM-85. Более того, репликация риновируса человека в эпителиальных клетках бронхов была снижена после стимуляции ОМ-85 [44, 45].
Иг у людей может измениться после введения OM-85; Повышение сывороточного и секреторного IgA и сывороточного IgG и снижение сывороточного IgE было описано у пациентов с астмой [30, 34, 38, 46]. Также наблюдались изменения в уровнях цитокинов и хемокинов в сыворотке со снижением сывороточного IL-4 и увеличением IL-10, IL-17 и IFN-γ [32, 35, 38, 42].Эти результаты согласуются с исследованием PMBL MV130, в котором увеличение сывороточного TNF-α, IL-1β, IL-6, IL-10, IL-17A, IL-23 и IFN-γ наблюдалось в сыворотке крови здоровых людей. лица и пациенты с рецидивирующими ИРО [14]. Все эффекты, представленные выше, суммированы на рисунке 4.
РИСУНОК 4Иммунологические эффекты бронхо-ваксома (OM-85) у животных и людей. Красный текст: только человек; курсив: только животные; жирный текст: человек и животное. PAMP: молекулярный паттерн, связанный с патогенами; NF-κB: ядерный фактор-κB; MAPK: митоген-активированная протеинкиназа; GALT: лимфоидная ткань, ассоциированная с кишечником; TGF: трансформирующий фактор роста; TLR: Toll-подобный рецептор; ИЛ: интерлейкин; Ig: иммуноглобулин; TNF: фактор некроза опухоли; Treg: регуляторные Т-клетки.
Обсуждение
Обострения заболеваний являются основной причиной заболеваемости хрипами и астмой в дошкольном возрасте. Поэтому профилактика обострений очень важна. В этом метаанализе мы приводим доказательства того, что бактериальные лизаты могут быть эффективными в профилактике обострений хрипов дошкольного возраста и астмы; наблюдаемый эффект был более выраженным в дошкольном возрасте. Более того, положительные эффекты наблюдаются в дни одышки у детей, дни приема антибиотиков при обострениях астмы и время между первым и вторым обострениями.
В этот систематический обзор мы включили исследования, проведенные со всеми существующими и коммерчески доступными препаратами бактериальных лизатов. Это противоречит недавнему метаанализу Yin et al. [20], который исследовал действие только одного препарата (OM-85) и включил множество неанглоязычных опубликованных исследований. Однако, в соответствии с нашим метаанализом, Yin et al. [20] сообщают о положительном эффекте OM-85 в плане уменьшения общего количества дней с хрипами.
В то время как бактериальные штаммы, присутствующие в этих бактериальных лизатах, схожи, введение и производство различаются: OM-85 — это капсула, принимаемая перорально с небольшим количеством жидкости, Ismigen — сублингвальная таблетка, а MV130 — сублингвальный спрей. Что еще более важно, Ismigen и MV130 являются PMBL с неденатурированными белками и поэтому могут вызывать другой иммунный ответ, чем OM-85, поскольку это PCBL. Поскольку почти все лабораторные исследования изучали действие OM-85, и только одно исследование показало иммунологические данные PMBL MV130, вполне вероятно, что описанные рабочие механизмы действительны только для OM-85.Необходимо провести дополнительные исследования для выявления этого и возможных дополнительных иммуномодулирующих путей у людей.
Иммуномодулирующий эффект бактериальных лизатов затрагивает как гуморальный, так и клеточный иммунитет. Основываясь на нескольких исследованиях in vitro, , животных моделях и исследованиях различных заболеваний человека, клинический эффект бактериальных лизатов основан на четырех клеточных механизмах. Во-первых, после стимуляции бактериальным лизатом дендритные клетки в пейеровских бляшках кишечно-ассоциированной лимфоидной ткани (GALT) запускают активацию антигенспецифических Т-лимфоцитов, которые модулируют переключение изотипа В-клеток на клетки, секретирующие Ig.Этот эффект опосредуется синтезом цитокинов и факторов роста [13, 18]. Активированные дендритные клетки, Т-лимфоциты и В-лимфоциты продолжают созревать и пролиферировать в мезентериальных лимфатических узлах. Во-вторых, генерируемые GALT клетки, в том числе Treg-клетки, мигрируют в грудной проток и распространяются системным кровообращением во внекишечные участки, включая верхние и нижние дыхательные пути [22, 23]. Это приводит к поликлональной активации иммунной системы, которая включает в себя как врожденные, так и адаптивные иммунные ответы с индукцией IFN-α и IFN-β и контроль чрезмерной воспалительной реакции за счет генерации Treg [13, 22].В-третьих, в исследованиях на животных показан широкий спектр иммунных ответов после нанесения бактериального лизата, включая поликлональную продукцию иммуноглобулинов, что приводит к снижению чувствительности к различным респираторным патогенам [19]. В-четвертых, чрезмерная воспалительная реакция и ослабление аллергической предрасположенности, вызванной Th3, может привести к коррекции дисбаланса лимфоцитов Th2 / Th3, при этом кажется вероятным, что бактериальные лизаты вызывают повышенную активацию клеток Th2, что может приводить к подавлению Th3 [18].Следует отметить, что изучение патофизиологии на животных моделях отличается от исследования на людях. В то время как во всех исследованиях на животных моделях изучались реакции местных дыхательных путей, у людей обычно исследовалась кровь. Кроме того, на результаты могут влиять видовые различия.
Другая гипотеза предполагает, что бактериальные лизаты могут усиливать постнатальное созревание функций Treg и Th2 лимфоцитов. Считается, что этот процесс физиологически управляется комменсальной микрофлорой желудочно-кишечного тракта [48].Влияние бактериальных лизатов на микробиом человека изучено недостаточно. Тем не менее, текущее исследование Orbex (NCT02148796) и исследование Breathe (NL5752) будут отвечать на эти интригующие вопросы.
В этом контексте стоит упомянуть, что исследования показали, что препараты, нацеленные на модификацию микробиома кишечника, включая пребиотики и пробиотики, могут предотвращать астму или уменьшать ее тяжесть [49]. Однако результаты недавно опубликованных систематических обзоров и метаанализа были довольно разочаровывающими.Не доказано, что введение пробиотиков в раннем возрасте снижает риск развития астмы или хрипов в дошкольном возрасте [50, 51]. Таким образом, согласно имеющимся данным, нет данных, подтверждающих использование пробиотиков в качестве дополнительного лечения при хрипах или астме в дошкольном возрасте.
Подводя итог, основываясь на вышеупомянутом гипотетическом рабочем механизме (рис. 4) , бактериальные лизаты можно рассматривать как эффективную дополнительную терапию при хрипах и астме дошкольного возраста, особенно когда пациент страдает рецидивирующим ИРТ.
Этот систематический обзор и метаанализ имеет несколько ограничений. Наша стратегия тщательного поиска выявила статьи 2016 года. Строгие критерии включения показали, что для этого обзора подходили только 22 статьи, из которых только пять были включены в метаанализ. Несмотря на то, что стратегия поиска была очень всеобъемлющей, некоторые исследования могли не быть идентифицированы, особенно если они никогда не публиковались или публиковались на менее часто индексируемых языках. Еще одним ограничением является то, что многие исследования, включенные в этот систематический обзор, имеют среднее качество, что может сделать наш обзор склонным к систематической ошибке.Чтобы определить надежный результат исследования, все опубликованные статьи были рассмотрены для метаанализа в этом исследовании.
В исследованиях, включенных в этот метаанализ, большинство исследований астмы проводилось у школьников, страдающих астмой, обычно с атопической астмой. В настоящее время нет доступных данных о влиянии бактериальных лизатов на взрослых с астмой, за исключением единственного сообщения, в котором описаны эффекты бактериальных лизатов при ХОБЛ, астме и аллергическом рините у пациентов с рецидивирующими ИРО [30].На сегодняшний день крупных РКИ по лечению астмы у взрослых не проводилось. В частности, эффекты бактериальных лизатов при неаллергической астме не описаны ни у взрослых, ни у детей.
Еще один вопрос возникает из анализа продолжительности лечения бактериальным лизатом в нашем метаанализе. Продолжительность вмешательства во всех включенных исследованиях составляла 3 месяца для OM-85 и 6 месяцев для MV-130. Не во всех исследованиях указано точное время года начала вмешательства. Эмерик и др. .[29] и Слай и др. . [33] учли сезонный характер частоты обострений и запланировали введение бактериальных лизатов до начала вирусного сезона. Исследование, оценивающее эффект от введения бактериальных лизатов в течение 12 месяцев подряд, должно предоставить новую информацию по этим вопросам.
Оптимальный режим терапии бактериальных лизатов, продолжительность терапии и целевая группа еще не определены. Ожидается, что два клинических испытания рассмотрят эти вопросы с точки зрения клинических исходов, таких как эпизоды одышки или обострения и функции легких, иммунологических параметров и изменений микробиома.Результаты исследования Breathe (NL5752), которое включает взрослых с тяжелой астмой, ожидаются в конце 2020 года, а результаты исследования Orbex (NCT02148796), которое включает детей в возрасте от 5 до 16 месяцев, подверженных риску развития астмы, являются ожидается в 2024 году.
Лечение астмы в основном состоит из терапевтического вмешательства с использованием β2-агонистов длительного действия и ингаляционных кортикостероидов (ICS) в соответствии с рекомендациями Глобальной инициативы по астме (GINA) [52]. Дозировки ICS увеличиваются до тех пор, пока не будет достигнут адекватный контроль астмы.Большинство пациентов с астмой достигают адекватного контроля с помощью низких и средних доз ИКС. Высокие дозы ИКС назначают 24% больных астмой [9]. Вместо того, чтобы увеличивать дозу ICS или использовать дополнительные биологические препараты, пациентам с частично или неконтролируемой астмой, которые часто страдают ИРО, может быть полезно дополнительное лечение бактериальным лизатом. Бактериальные лизаты хорошо переносятся и доступны по разумной цене в нескольких странах Европы и Азии. Принимая во внимание побочные эффекты поддерживающих пероральных кортикостероидов или пероральных антибиотиков, ожидается, что бактериальные лизаты будут более безопасными и более рентабельными, даже если их клиническая эффективность умеренная [52, 53].
Этот обзор показывает, что бактериальные лизаты представляют собой многообещающее дополнение к текущему лечению хрипов дошкольного возраста и детской астмы. Существует огромная потребность в плацебо-контролируемых РКИ у взрослых с различными фенотипами астмы, чтобы определить, действительно ли существует место для бактериальных лизатов в качестве дополнительной терапии у взрослых с астмой.
Однако, основываясь на этом метаанализе и систематическом обзоре, бактериальные лизаты можно рассматривать как безопасную и эффективную дополнительную терапию при хрипах дошкольного возраста и у детей с рецидивирующими обострениями астмы.
Дополнительный материал
Дополнительный материал
Обратите внимание: дополнительный материал редакцией не редактируется, а загружается в том виде, в каком был предоставлен автором.
Дополнительная_информация ERR-0175-2019_Supplementary_information
Выражение признательности
Мы благодарим К. де Йонга и Н. ван Хаутена (Медицинская библиотека Франциска Гастуиса и Влитланда, Роттердам, Нидерланды) и А. Айдукевича (Библиотека Таркха) Варшавский медицинский университет, Варшава, Польша) за помощь в подготовке поиска по базе данных.
Сноски
Происхождение: Отправленная статья, рецензирование
В этой статье есть дополнительные материалы, доступные на err.ersjournals.com
Авторские работы: G.A. Первоначальную идею этого обзора придумали Трампер-Страндерс и В. Фелешко. Г. de Boer, J. ółkiewicz и K. Strzelec выполнили поиск и выбрали исследования для этого обзора и метаанализа. Г. де Бур и Й. Жулкевич провели метаанализ под руководством М.Рущинский. Г. де Бур, Г.А. Tramper-Stranders и G.J. Брауншталь построил таблицу 1. G.M. де Бур, Г.А. Tramper-Stranders и R.W. Hendriks проанализировали данные иммунологии и построили рисунок 4. G.M. де Бур, В. Фелешко, Г.А. Трампер-Страндерс написал рукопись, и все авторы рецензировали ее на разных этапах. Все авторы одобрили окончательный вариант рукописи.
Конфликт интересов: G.M. де Бур нечего раскрывать.
Конфликт интересов: J.Жолкевичу нечего раскрывать.
Конфликт интересов: К. Стшелецу нечего раскрывать.
Конфликт интересов: М. Рущински нечего раскрывать.
Конфликт интересов: R.W. Hendriks нечего раскрывать.
Конфликт интересов: G.J. Брауншталь нечего раскрывать.
Конфликт интересов: В. Фелешко сообщает о гонорарах докладчикам от Vifor Pharma.
Конфликт интересов: Г.А. Трампер-Страндерс сообщает о грантах Европейского общества детских инфекционных заболеваний, Stichting Coolsingel, а также о гранте, личных гонорарах и нефинансовой поддержке со стороны OM-Pharma для аффилированного проекта во время проведения исследования. Все гонорары были выплачены исследовательскому фонду.
- Получено 18 декабря 2019 г.
- Принято 26 мая 2020 г.
Очистка белков — Экстракция и осветление — Получение клеточных лизатов из E.coli
Для получения клеточных лизатов из E.coli клеток:
Обработка ультразвуком. Обработка ультразвуком — самый популярный метод лизиса небольших количеств клеток (1-6 л клеточной культуры). Клетки лизируются жидким сдвигом и кавитацией. ДНК также разрезается во время обработки ультразвуком, поэтому нет необходимости добавлять ДНКазу в суспензию клеток. Основная проблема — это контроль температуры. Это решается путем выдерживания суспензии на льду и использования ряда коротких импульсов (5-10 секунд) с паузами (10-30 секунд) для восстановления низкой температуры.Для количества клеток более 50 г метод имеет ограниченную ценность из-за трудности поддержания низких температур и длительного времени обработки ультразвуком, необходимого для достижения адекватного лизиса.
Гомогенизация. Гомогенизаторы — самые распространенные устройства для лизиса бактерий. Прессы лизируют клетки, нагнетая суспензию клеток и внезапно сбрасывая давление. Это создает жидкий сдвиг, способный лизировать клетки. Типичное рабочее давление для гомогенизаторов старого типа, французского пресса и гомогенизатора Manton-Gaulin, составляет 6000-10 000 фунтов на квадратный дюйм.Для достижения адекватного лизиса обычно требуется несколько (2-3) проходов. Однако высокое рабочее давление приводит к повышению рабочих температур. Поэтому ячейки под давлением охлаждаются (4 ° C) перед использованием. В дополнение к контролю температуры следует проявлять осторожность, чтобы избежать инактивации белков из-за пенообразования.
Современные гомогенизаторы часто бывают непрерывного действия и могут работать при более высоких давлениях. В EMBL у нас есть Avestin Emulsiflex-C5, который эффективно лизирует клеток E. coli за один проход при давлении 15000 фунтов на квадратный дюйм (100 МПа).
Ферментативный лизис с использованием лизосима. Ферментативный лизис основан на переваривании пептидогликанового слоя клеточной стенки бактерий лизосимом. Однако грамотрицательные бактерии имеют внешнюю мембрану, которая находится вне клеточной стенки и должна быть проницаемой, чтобы обнажить пептидогликановый слой. Трис, часто используемый в качестве буфера в методах лизиса, эффективно усиливает проницаемость внешних мембран. Этот эффект можно усилить добавлением ЭДТА (1 мМ). EDTA хелатирует ионы магния, которые стабилизируют мембраны.Во время лизиса клеток часто высвобождается много ДНК, и возникает необходимость добавить ДНКазу (1 мг / мл) для уменьшения вязкости препарата. Ферментативный лизис клеток можно проводить в любом масштабе, но для крупномасштабных препаратов лизосим и ДНКаза могут быть дорогими. Для увеличения уровня лизиса клеток раствор можно обработать ультразвуком (см. Выше).
Замораживание и измельчение. Альтернативный метод лизиса заключается в замораживании клеток непосредственно в жидком азоте и измельчении замороженных клеток в порошок с помощью ступки и пестика, которые охлаждаются жидким азотом.Порошок можно хранить неограниченное время при -80 ° C, а лизат клеток можно приготовить, добавив порошок к 5 объемам буфера.
Эффективность поливалентного бактериального лизата у детей с рецидивирующими инфекциями дыхательных путей
Bellanti JA. Рецидивирующие инфекции дыхательных путей у детей. Наркотики . 1997; 54: 1–4.
Артикул PubMed Google ученый
Таунс С., Вонг М. Оценка ребенка с рецидивирующими респираторными инфекциями. Врач Aust Fam . 2000; 29: 741–746.
CAS PubMed Google ученый
Вассерманн Р.Л., Соренсен РУ. Оценка детей с инфекциями дыхательных путей: роль иммунизации бактериальной полисахаридной вакциной. Pediatr Infect Dis J . 1999. 18: 157–163.
Артикул Google ученый
Корппи М. Рецидивирующие респираторные инфекции у детей: практический подход к клинической работе. Педиатр Пульмонол . 1997. 16: 144–145.
CAS Google ученый
Nafstad P, Hagen JA, Oie L, Magnus P, Jaakkola JJK. Центры дневного ухода и респираторное здоровье. Педиатрия . 1999. 103: 753–758.
Артикул CAS PubMed Google ученый
Ferrari M, Tardivo S, Zanolin ME и др. Серьезные детские респираторные инфекции и астма во взрослой жизни. Популяционное исследование. Ann Allergy Asthma Immunol . 1999; 83: 391–396.
CAS PubMed Статья Google ученый
Паолетти П., Предилетто Р., Карроцци Л. и др. Воздействие респираторных инфекций у детей и подростков и взрослых на население в целом. Eur Respir J .1989; 2: 428–436.
CAS PubMed Google ученый
Celedon JC, Litonjua AA, Weiss ST, Gold DR. Посещение дневного стационара на первом году жизни и болезни верхних и нижних дыхательных путей у детей с семейным анамнезом атопии. Педиатрия . 1999; 104: 495–500.
Артикул CAS PubMed Google ученый
Jedrychowski W, Maugeri U, Flak E, Mroz E, Bianchi I. Предрасположенность к острым респираторным инфекциям среди детей младшего возраста с избыточной массой тела: эпидемиологическое исследование в Польше. Общественное здравоохранение . 1998. 112: 189–195.
CAS PubMed Google ученый
Van Cauwenberge PB, Belussi L, Maw AR, Paradise JL, Solow B. Аденоид как ключевой фактор при инфекциях верхних дыхательных путей. Int J Педиатр Оториноларингол .1995; 32 (доп.): 71–80.
Артикул Google ученый
Lundbäck B. Эпидемиология ринита и астмы. Clin Exp Allergy . 1998; 28: 3–10.
PubMed Google ученый
Bolte G, Mielck A, Meyer I., Stiller-Winkler R, Heinrich J. Обратный социальный градиент параметров вторичного иммунного ответа у детей. Rev Environ Health .1999. 14: 135–143.
CAS PubMed Google ученый
Шапиро ЭД. Эпидемиология ОРЗ. Semin Pediatr Infect Dis . 1998; 9: 31–36.
Артикул Google ученый
Латал Хайнал Б., Браун-Фарлендер С., Гриз Л. и др. Влияние воздействия табачного дыма из окружающей среды на респираторные симптомы у детей. Schweiz Med Wochenschr . 1999; 129: 723–730.
Google ученый
Jedrychowski W, Flak E. Курение матери во время беременности и послеродовое воздействие табачного дыма из окружающей среды как факторы предрасположенности к острым респираторным инфекциям. Специалист по охране здоровья окружающей среды . 1997; 105: 302–306.
Артикул CAS PubMed Google ученый
Drummond PD, Hewson-Bower B. Повышенный психологический стресс и снижение иммунитета слизистых оболочек у детей с рецидивирующими инфекциями верхних дыхательных путей. J Psychosom Res . 1997; 43: 271–278.
Артикул CAS PubMed Google ученый
Helmberg A, Böck G, Wolf H, Wick G. Пероральный бактериальный иммуномодулятор подготавливает нейтрофилы кролика к усилению окислительного взрыва в ответ на инфекцию опсонизированным зимозаном. Иммунология . 1989; 57: 3576–3580.
CAS Google ученый
Ruedl CH, Albin B, Böck G, Wick G, Wolf H. Пероральное введение бактериального иммуномодулятора усиливает движение собственной пластинки кишечника мышей и лимфоцитов Пейера в легкие: возможные последствия для профилактики и лечения инфекционных заболеваний. Инт Иммунол . 1993; 5: 29–36.
Артикул CAS PubMed Google ученый
Ruedl CH, Frühwirt M, Wick G, Wolf H. Иммунный ответ в легких после пероральной иммунизации бактериальными лизатами респираторных патогенов. Clin Diagn Lab Immunol . 1994; 1: 150–154.
CAS PubMed Google ученый
Van Daal GJ, Beusenberg FD, So KL, et al. Защита от заражения вирусом гриппа мышей путем пероральной иммунизации поливалентным бактериальным лизатом. Инт Дж. Иммунол .1991; 13: 831–840.
Артикул Google ученый
Van Daal GJ, van’t Veen A, So KL, et al. Пероральная иммунизация поливалентным бактериальным лизатом и инфекция Streptococcus pneumoniae : влияние на концентрации гамма-интерферона и PMN-эластазы в жидкости бронхоальвеолярного лаважа мышей. Инт Иммунол . 1993; 5: 29–36.
Артикул Google ученый
Wichels R, Wolfschaffner F, Guggenbichler JP. Профилактика инфекций. TW Pädiatrie . 1996; 9: 421–423.
Google ученый
Riedl-Seifert RJ, van Aubel A, Kämmereit A, et al. Рецидивирующие инфекции в детстве: являются ли они по-прежнему ключевой проблемой? [на немецком]. J Pharmacol Ther . 1992; 2: 108–117.
Google ученый
Rutishauser M, Pitzke P, van Aubel A, Elsasser U, Grevers G, Kämmereit A. Использование поливалентного бактериального лизата у пациентов с рецидивирующими инфекциями дыхательных путей. Adv Ther . 1998. 15: 330–341.
CAS PubMed Google ученый
Гуч WM. Возможные инфекционные осложнения инфекций верхних дыхательных путей. Pediatr Infect Dis J . 1998. 17: 79–82.
Артикул Google ученый
Openshaw PJ, Леманске РФ. Респираторные вирусы и астма: можно ли предотвратить последствия? Eur Respir J . 1998; 12 (доп. 27): 35С-39С.
Google ученый
Mushatt DM. Достижения в антимикробной терапии инфекций дыхательных путей. Curr Opin Pulm Med . 2000. 6: 250–253.
Артикул CAS PubMed Google ученый
Staats HF, McGhee JR. Применение основных принципов иммунитета слизистых оболочек при разработке вакцины. В: Kiyono H, Ogra PL, McGhee JR, ред. Вакцины для слизистых оболочек . Сан-Диего, Калифорния: Academic Press; 1996: 17–39.
Google ученый
Stead RH, Bienenstock J. Разработка новых оральных вакцин и иммуномодуляторов.В: Riedl-Seifert RJ, ed. Иммунология слизистой оболочки . Мюнхен: Zuckschwerdt Verlag; 1998: 119–128.
Google ученый
Уокер Р.И. Новые стратегии вакцинации слизистых оболочек для более эффективной иммунизации. Вакцина . 1994; 12: 387–400.
Артикул CAS PubMed Google ученый
Monto AS, Sullivan KM.Острое респираторное заболевание в сообществе. Частота заболевания и вовлеченные агенты. Эпидемиол. Инфекция . 1993; 110: 145–160.
CAS PubMed Статья Google ученый
Джонс Н.С. Современные концепции лечения детского риносинусита. Дж Ларингол Отол . 1999; 113: 1–9.
CAS PubMed Google ученый
Stögmann W. Das Infektanfällige Kind. Тэгл Практ . 1992; 3: 283–294.
 Зачастую от вмешательства в pH кожи различными косметическими средствами, в том числе антибактериальными, микрофлора кожи обедняется, что ведет к усиленному размножению патогенных микроорганизмов и, как следствие, к различным дерматологическим заболеваниям.
Зачастую от вмешательства в pH кожи различными косметическими средствами, в том числе антибактериальными, микрофлора кожи обедняется, что ведет к усиленному размножению патогенных микроорганизмов и, как следствие, к различным дерматологическим заболеваниям.