Вирусы и бактерии — Мастерок.жж.рф — LiveJournal
В посте про «обувные рентгеновские аппараты» некоторые комментаторы, отметили что с «испанкой» антибиотиками не борются. С этим трудно не согласится, ведь бактерии от вирусов очень сильно отличаются. Методы борьбы с ними разные. Пример про «испанку» и антибиотики был взят для наглядности, времени, когда это было. А это всего то 100 лет назад. Тогда люди не умели, как сейчас, бороться с вирусами и бактериями. Так как не было противовирусных средств и антибиотиков, от многих возбудителей. Сейчас же при использование всех современных разработок и технологий, удалось бы спасти многие жизни. Но давайте немного узнаем про вирусы и бактерии.
Бывает, заболев ОРВИ или гриппом, люди спешат в аптеку за антибиотиком, не отдавая себе отчета в том, что вирусное заболевание им вылечить невозможно. Ведь антибиотик — лекарство, направленное на подавление болезнетворных бактерий, но никак не вирусов. От последних могут помочь только противовирусные препараты.
Примечательно, что вирус имеет гораздо меньшие размеры, чем бактерии. Потому они и способны проходить через антибактериальный фильтр. Размер вируса варьирует от нескольких десятков до трёхсот нанометров. Они недоступны для микроскопического исследования через световое оборудование. Именно это долгое время не позволяло их обнаружить даже при исследовании тканей заражённых организмов.
Проникая в клетки вирусы, начинают свою пагубную деятельность. Иммунная система человека вырабатывает антитела, которые отправляются на поиски злобного паразита. Только вот ни антитела, ни лейкоциты из-за своих огромных размеров не могут проникать сквозь мембрану оболочек человеческих клеток. Обычно соединительная ткань, где находятся микробы, хорошо омывается кровью, а присутствие в организме ее насыщенной антибиотиком помогает мгновенно справляться с ними.
Вирусы проникают в клетку живого организма или бактерию и заставляют органоиды (рибосомы) клетки синтезировать вирусные белки, из которых потом собираются множественные копии вируса. При выходе вирусов из клетки чаще всего происходит её гибель. Новые вирусы с большой скоростью захватывают другие клетки. Так вирус заставляет организм работать на себя. Так, собственно, и прогрессирует инфекция.
Вирус либо разрушает клетку хозяина, либо провоцируют ответ иммунной системы, который проявляется такими симптомами, как чувство усталости, повышение температуры и даже тяжелое повреждение тканей.
Если визуально представить себе огромный дом в 20-25 этажей, то маленькая, упавшая с подоконника коробка спичек это соотношение размеров микроба и вируса. Потому им легко паразитировать, функционировать, питаясь цитоплазмой, при этом, не повреждая внешние ее клетки. Некоторые даже используют в свою пищу микробов, подобные вирусы еще называют фагоцитами.
Иммунная система, как и многие другие физиологические системы, состоит из молекул, клеток, тканей и органов. Главный орган иммунной системы — это вилочковая железа, или тимус — орган, который находится за грудиной и производит особые клетки, самые главные клетки иммунной системы.
— По сути это клетки-регуляторы и клетки-солдаты, и эта армия стоит на защите нашего организма. Но к встрече с вирусом ее нужно готовить. На формирование иммунитета уходит от двух недель до трёх месяцев после прививки. Поэтому ее лучше делать не накануне, а до предположительного времени эпидемии.
Клетки вакцинированного человека подготовлены и научены бороться с вирусом в отличие от клеток невакцинированного. Они выделяют антитела, которые блокируют вирус. Профилированная клетка знает, какие частички нужно выработать, чтобы заблокировать конкретный вирус. Поэтому организм нужно готовить к возможной встрече с вирусом — иммунизировать вакциной, содержащей антигены.
Таким образом, строение вируса предполагает паразитический образ жизни, который необходим микроорганизмам для защиты от окружающей среды. Хотя вирусы достаточно свободно передвигаются в пространстве от одного хозяина к другому. Поэтому они создают высокий риск эпидемий тех заболеваний, где вирусы выступают возбудителем.
Вирус табачной мозаики поражает не только растения табака, но и плодовую мушку, которая им питается. Таким образом, продлевая жизнь мушки и её плодовитость (принося пользу), вирус вредит растениям;
Вирус, поражающий грибок, который размножается в траве возле геотермальных источников, позволяет растению выживать в условиях повышенной температуры. Это выгодно вирусному организму для сохранения хозяина в труднодоступных для истребления местах, где температура достигает 50 градусов по Цельсию;
Некоторые вирусы защищают организм хозяина от проникновения и размножения в организме других вирусных агентов. Вирус охраняет свою территорию и в некоторых случаях не приносит значительного вреда хозяину для сохранения места проживания.
Интересно, что с течением времени такие вирусы становятся не столько паразитами, сколько частью самого организма. Поэтому он начинает передаваться из поколения в поколение и определяется генетическим кодом, как полезное свойство, которое подлежит передаче. Таким образом, вирус сохраняет свое место и наделяет организм хозяина новыми свойствами для выживания.
Передаваться вирусы могут также от больных животных. Часто причиной становится употребление заражённого мяса или тесный контакт с заражёнными особями. Хотя существуют и вирусы, которые не способны передаваться между видами. Такие микроорганизмы для человека и других животных относительно безопасны. Чаще всего человек заражается, употребляя мясо крупного рогатого скота и домашней птицы. Но известны вирусы, которые разносятся дикими животными, например, голубями. Кроме того, при укусах заражённых млекопитающих передаётся вирус бешенства и другие.
Человек может передавать вирусную инфекцию разными путями. В зависимости от локализации возбудителя и особенностей заболевания выделяются следующие пути передачи от человека к человеку:
Воздушно-капельный. Такой вариант передачи присущ в основном вирусам, поражающим дыхательную систему. Вирус витает в воздухе и передаётся потенциальному хозяину в момент вдыхания заражённых воздушных масс;
Половой. Многие вирусы локализуются на слизистых оболочках, затем поражая весь организм. Нередко такие паразиты попадают в организм здорового человека при половом контакте. При этом даже использование презерватива не всегда может защитить от заражения. Влажные поцелуи также могут стать причиной заражения;
Гематогенный. Это происходит в процессе переливания заражённой крови. Чаще всего такое бывает при экстренном переливании, когда кровь не проходит должной проверки с обязательным периодом хранения;
Бытовой. В некоторых случаях вирус может передаваться через личные вещи или попадание на повреждённую кожу заражённых выделений организма больного. Таким путём может передаваться ряд вирусных гепатитов и СПИД, хотя и считается, что вероятность заражения в этом случае относительно низкая.
Некоторые вирусы требуют также хирургического вмешательства для устранения очага инфекции. В частности, представителей контагиозного моллюска или папилломатозные образования (ВПЧ) необходимо удалять хирургическим путём. После удаления проводят иммуномодулирующую терапию, которая направлена на восстановление защитных функций организма. Любой вирус опасен тем, что вызывает подавление иммунной системы, подвергая организм опасности заражения любыми заболеваниями. Особенно этим отличается ВИЧ. Поэтому с ним так сложно бороться и поддерживать жизнеспособность пациента.
Вирусы окружают нас и могут проникать в наш организм. Становясь паразитами, они начинают отбирать ресурсы человеческого организма и медленно убивать нас. Поэтому важно соблюдать меры предосторожности и своевременно проходить вакцинацию. Особенно это важно для тех, кто по профессии много контактирует с людьми, которые могут быть заражены какими-либо вирусами.
В связи с возможностью передачи вируса даже по воздуху или через слизистые оболочки следует укреплять свое здоровье и избегать сомнительных контактов. Беспорядочные половые связи и тесное взаимодействие с больным человеком может привести к заражению. При этом человек может даже не знать о том, что имеет заболевание, и вести самый обычный образ жизни. Поэтому лучше всегда быть осторожными в общении, а также заботиться о себе и своих близких.
Вирус быстро размножается, поедая цитоплазму клеток, вскоре ему становится мало полученного, и он пробивает оболочку клетки, сразу атаковывается антителами. Но если иммунитет упал, то медикаментозное воздействие может рекомендовать врач, например использование иммуноглобулина. Тогда кровью с активными веществами вирус убивать проще, тем более, когда ни уже остались незащищенными и вышли из человеческих клеток. С успехом используются в антивирусной терапии ацикловир, вирамун, эпивир, ремантадин и другие препараты. Именно по этой причини вирусы бесполезно лечить антибактериальной терапией.
«Ахиллесова пята» любого вируса – это неконтролируемое размножение вызывающее разрыв клеточной мембраны своего «укрытия». И вроде все прекрасно сначала он попадает в клетку, скоро размножается и вырывается в кровь, где его смывает потом антивирусными препаратами.
Но вся сложность состоит в том, что более девяноста процентов вирусов в человеческом организме находится именно в клетках, а там их не убить и не достать. То есть, по сути, лекарствами их не убить, а пока синтезируются антитела и глобулины внутри организма, особенно если у человека слабый иммунитет пройдет много времени. А за этот период вирус может нанести достаточно вреда организму. Ученых тревожит незащищенность нашего тела от вирусной природы заболеваний.
Бактерии: бактерии являются прокариотическими клетками, которые показывают все характеристики живых организмов. Бактериальные клетки содержат органеллы и ДНК, которые погружены в цитоплазму и окружены клеточной стенкой. Эти органеллы выполняют жизненно важные функции, позволяющие бактериям получать энергию из окружающей среды и воспроизводится.
Вирусы: Вирусы не считаются клетками, а существуют как частицы нуклеиновой кислоты (ДНК или РНК), заключенные в оболочку белка. Также известные как вирионы, вирусные частицы существуют где-то между живыми и неживыми организмами. Хотя они содержат генетический материал, они не имеют клеточной стенки или органелл, необходимых для производства и воспроизводства энергии. Вирусы полагаются исключительно на клетку-хозяина для репликации.
В то время как большинство бактерий безвредны, а некоторые даже полезны для людей, другие бактерии способны вызывать заболевания. Патогенные бактерии, которые вызывают заболевание, продуцируют токсины, разрушающие клетки организма. Они могут вызывать пищевое отравление и другие серьезные заболевания, включая менингит, пневмонию и туберкулез.
Бактериальные инфекции можно лечить антибиотиками, которые очень эффективны при уничтожении бактерий. Однако из-за чрезмерного использования антибиотиков бактерии получили сопротивление к ним. Некоторые из них даже стали известны как супербактерии, поскольку получили устойчивость к множеству современных антибиотиков. Вакцины также полезны для предотвращения распространения бактериальных заболеваний. Лучший способ защитить себя от бактерий и других микробов — это правильно и часто мыть руки.
Вирусы являются патогенами, которые вызывают ряд заболеваний, включая ветрянку, грипп, бешенство, Эбола, болезнь Зика и ВИЧ/СПИД. Вирусы способны вызывать постоянные инфекции, в которых они находятся в состоянии покоя, и могут быть повторно активированы позднее. Некоторые вирусы вызывают изменения в клетках-хозяевах, которые приводят к развитию рака. Известно, что эти вирусы вызывают раковые заболевания, такие как рак печени, рак шейки матки и лимфома Беркитта. Антибиотики не работают против вирусов. Лечение вирусных инфекций обычно связано с лекарствами, которые лечат симптомы инфекции, а не сам вирус. Как правило, иммунная система самостоятельно борется с вирусами. Вакцины также могут использоваться для предотвращения некоторых вирусных инфекций.
Некоторые из вирусов настолько изменчивы, что иммунная система просто не успевает выработать против них надёжный ответ – антитела против вирусных белков очень быстро устаревают и не видят новые, изменившиеся вирусные частицы. Другие же проходят под иммунными «радарами» с помощью невольных союзников. Например, вирус полиомиелита проникает в организм с помощью кишечной микрофлоры: иммунная система воспринимает симбиотические бактерии как друзей, вирусы же используют бактериальные клетки как прикрытие, делающее их невидимыми для защитных систем. Наконец, поскольку сигнал об опасности передаётся в иммунитете через целый ряд молекулярно-клеточных «инстанций», можно просто вклиниться в сигнальную цепочку и, образно говоря, перерезать провод.
Именно так поступают аденовирусы, которым мы обязаны острыми респираторными и кишечными инфекциями, конъюнктивитами и т. д. ДНК аденовирусов упакована в комплексе с белком, который называют протеином VII. Он помогает свернуть, компактизовать вирусный геном, чтобы он поместился в небольшой вирусной частице – по сути, протеин VII выполняет ту же функцию, что и гистоны в наших клетках, без которых наша ДНК ни в какое клеточное ядро бы просто не влезла.
Лекарств от вирусной инфекции не существует? На самом деле, они есть. Большинство противовирусных препаратов действуют по одному из трех механизмов.
Первый – стимуляция собственных защитных сил организма к борьбе с вирусом. Так действуют, например, «Арбидол» и «Циклоферон».
Второй – нарушение структуры новых вирусных частиц. Подобного рода лекарственные препараты представляют собой измененные аналоги азотистых оснований, служащих материалом для синтеза нуклеиновых кислот. Из-за структурного сходства они встраиваются в ДНК или РНК размножающегося в клетках вируса, делая новые вирусные частицы дефектными, неспособными к поражению новых клеток. Пример такого препарата – ацикловир, применяющийся для лечения герпетических инфекций.
Третий механизм – не допустить попадание вируса в клетку. Лекарство препятствуют отсоединению вирусной ДНК или РНК от белковой оболочки, из-за чего генетический материал вируса теряет способность проникать сквозь клеточную мембрану. Так действует, например, ремантадин.
Все вышеперечисленные препараты действуют только на активно размножающиеся вирусы.
В последние годы предпринимаются попытки генной терапии вирусных инфекций, то есть борьбы с вирусами с помощью… вирусов. Для этого геном подходящего вируса (такой вирус называется вектором) модифицируют. Во-первых, его лишают болезнетворных свойств. Во-вторых, к нему добавляют последовательность генов, которая при взаимодействии с геномом вируса, на который направлено лечение, «выключают» его. После этого вектор с генами вводят в организм человека, страдающего вирусной инфекцией. Этот метод лечения пока находится в стадии разработки и подтверждения эффективности и безопасности, но есть надежда, что в ближайшие годы генная терапия вирусных инфекций станет доступной.
Кроме того, существуют вирусы, избирательно поражающие бактериальные клетки. Они называются бактериофагами (буквально – «пожиратели бактерий»). Было множество попыток использовать их для борьбы с бактериальными инфекциями, однако весомых преимуществ перед антибиотиками они не показали. Бактериофаги применяются в генной инженерии для доставки необходимого генетического материала в бактериальные клетки.
[источники]Источник:
13min.ru/nauka/chto-takoe-virus-i-kak-bo
natworld.info/raznoe-o-prirode/osnovnye-o
pochemy-nelzya.info/unichtozhit-virus/
medportal.ru/budzdorova/health/virusy-i-b
Это копия статьи, находящейся по адресу http://masterokblog.ru/?p=36843.
Разница между бактериями и вирусами

Какая разница между бактерией и вирусом? Вы можете подумать, что это странный вопрос, поскольку оба являются микроорганизмами, а это означает, что ни один из них не виден невооруженным глазом. И то, и другое может вызвать у нас рвоту, диарею, лихорадку и даже бросить нам вызов опасным для жизни заболеваниям, но какие различия между ними?
Они оба плохие?
Прежде всего, они не злые монстры. Вирусы определенно большие злодеи, чем бактерии.
Для начала, бактерии являются частью нашей «нормальной флоры», и триллионы из них живут внутри нас, не причиняя никакого вреда. Они полезны, потому что они могут улучшить пищеварение и защитить нас от инфекций. Бактерии, подобные молочнокислым бактериям (LAB), в основном из видов Enterococcus и Lactobacillus , связаны с ферментацией пищи; эти ферментированные продукты приносят пользу для здоровья тем, кто их ест.
Вирусы не делают такой вещи! Они похожи на тех эгоистичных людей в нашей жизни, которые используют нас, когда им нужно, а потом забывают о нас. Вирусы не могут расти без хозяина, потому что им нужен хозяин, чтобы размножаться и процветать, поэтому они используют хозяина как свою платформу для размножения, а затем уничтожают хозяина. Тихое зло, не правда ли?
Бактериальная инфекция против вирусной инфекции — чем они отличаются?
Еще одно доказательство того, что бактерии и вирусы отличаются друг от друга, заключается в том, что когда вы обращаетесь к врачу с ангиной и лихорадкой, врач иногда вводит вам антибиотики, но в других случаях он позволяет инфекции проходить просто так. Это потому, что бактериальные инфекции можно лечить с помощью антибиотиков, но антибиотики неэффективны против вирусных инфекций. Таким образом, если вы испытываете вирусную атаку и принимаете антибиотики, вы можете не чувствовать никакой разницы в своем состоянии, но если это бактериальная инфекция, тогда антибиотики будут атаковать и убивать бактерии, заставляя вас чувствовать себя лучше.
Этот аспект выбора метода лечения дает понять, что понимание основных различий между бактерией и вирусом имеет решающее значение. Давайте начнем с установления краткого понимания обоих.
Бактерии — Крошечные Воины
Бактерии — это одноклеточные, прокариотические (без мембраносвязанного ядра или органелл) микроскопические организмы, которые делятся путем деления на две части. Они обычно имеют размер от 0,5 до 1,5 мкм, но могут также находиться в диапазоне 1-3 мкм. Будучи такими маленькими, их можно увидеть с помощью светового или электронного микроскопа. Они оба полезны и вредны для нас. Они существуют повсюду вокруг нас — в воздухе, воде, почве, и в нашем теле.
Вирусы — крошечные пакеты генов
Вирусы — это инфекционные агенты, у которых отсутствует клеточная структура. Они, однако, содержат вирусный генетический материал — либо ДНК, либо РНК, но не оба одновременно. Этот генетический материал заключен в высокоспециализированную белковую оболочку, которая защищает генетический материал, когда вирус находится вне клетки-хозяина, но также помогает вирусу проникать в слабую клетку-хозяина. Поскольку они не имеют клеточной структуры, но содержат гены, вирусы — это не что иное, как крошечные пакеты генов, перемещающихся от хозяина к хозяину.
Вирусы намного меньше, чем бактерии, и составляют от 0,015 до 0,2 мкм. Они настолько малы, что их нельзя увидеть под световым микроскопом, и для их изучения необходим электронный микроскоп.
Лучший способ представить себе размер вируса — это думать о машине как о бактерии; футбольный мяч, рядом с автомобилем, был бы вирусом! Вирусы могут расти только внутри клетки-хозяина посредством репликации (реплики вируса создаются внутри клетки-хозяина) и зависят от клеток-хозяев для выполнения жизненно важных функций. Поэтому их называют «облигатными внутриклеточными паразитами».
Бактерии против Вирусов
Некоторые вызывают заболевание, улучшают пищеварение, способствуют нашему иммунитету против патогенов. Некоторые играют важную роль в переработке элементов, которые способствуют плодородию почвы.

| Характеристики | Бактерии | Вирус |
| Размер | 0,5-1,5 мкм обычно | 0,015 — 0,2 мкм |
| Микроскопия | Световая или электронная микроскопия | Только электронная микроскопия |
| Количество клеток | одноклеточный | Нет клеток — это маленькие пакеты генов! |
| Клеточная стенка | Есть | Отсутствует — вместо этого присутствует белковая оболочка. |
| Органеллы | Есть | Нет |
| Генетический материал | ДНК или РНК, плавающие в цитоплазме | ДНК или РНК в оболочке белка |
| репродукция | Бесполое — размножается делением | Репликация внутри клетки-хозяина — «облигатные внутриклеточные паразиты» |
| Рост в искусственных лабораторных средах | Возможно | Невозможно — необходима культура тканей |
| Инфекция | В основном локализовано | систематический |
| лечение | Антибиотики | Антивирусные препараты |
| Клеточный механизм | Есть | Отсутствует |
| Практическое значение | Некоторые вызывают заболевание, улучшают пищеварение, способствуют нашему иммунитету против патогенов. Некоторые играют важную роль в переработке элементов, которые способствуют плодородию почвы. | Вызывают заболевания у людей, других животных, растений и даже других микроорганизмов |
Неклеточные формы жизни. Вирусы и бактериофаги. Видеоурок. Биология 10 Класс
Грипп, ОРЗ, СПИД, ящур, атипичная пневмония, бешенство, краснуха, корь, энцефалит, детский паралич… Список можно продолжить. Наверняка каждый из нас неоднократно слышал об этих заболеваниях. Что у них общего? Каким образом они возникают? Сегодня на уроке, тема которого «Неклеточные формы жизни. Вирусы и бактериофаги», мы постараемся ответить на эти и другие вопросы. Мы познакомимся с открытием вирусов, изучим особенности их строения и классификацию.
В 1892 году Д.И. Ивановский (см. Рис. 1), изучая мозаичную болезнь табака (см. Рис. 2), установил, что причиной заболевания является некое инфекционное начало, содержащееся в листьях больных растений, которое проходит через фильтр, задерживающий обыкновенные бактерии. Если профильтрованный сок внести в листья здоровых растений, то они также заболевают мозаичной болезнью.

Рис. 1. Д.И. Ивановский

Рис. 2. Мозаичная болезнь табака
В 1898 году независимо от Ивановского аналогичные результаты получил голландский микробиолог М. Бейеринк. Однако он предположил, что мозаичную болезнь табака вызывают не мельчайшие бактерии, а некое жидкое заразное начало, которое он назвал фильтрующим вирусом.
Размеры вирусов определяются нанометрами (20-200 нм), поэтому их изучение началось после открытия электронного микроскопа. В настоящее время описаны вирусы практически всех групп живых организмов.
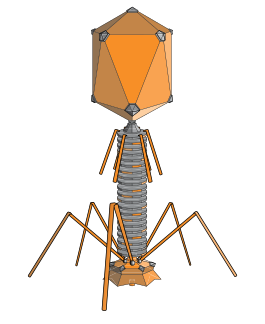
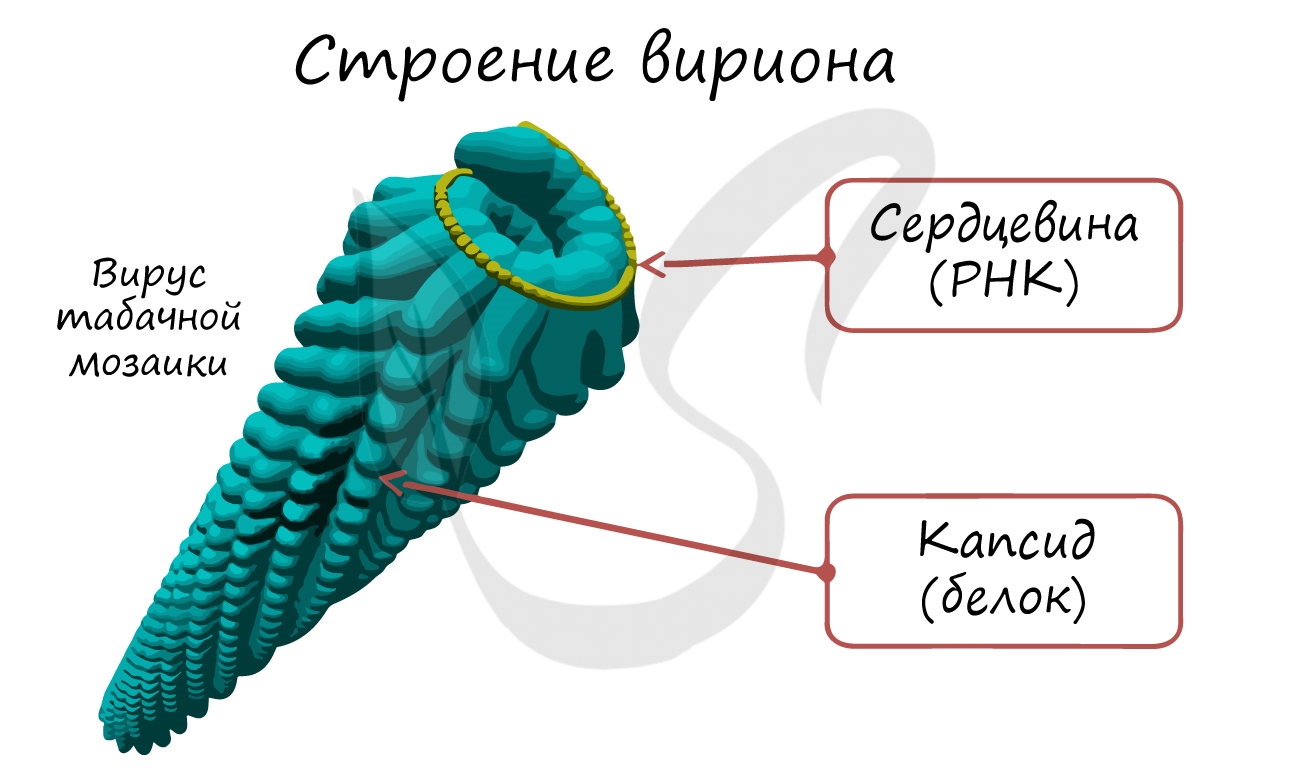
Вирусы – неклеточные формы жизни. Они состоят (см. Рис. 3) из фрагмента генетического материала (РНК или ДНК), составляющего сердцевину вируса, и защитной оболочки, которая называется капсид. У некоторых вирусов (герпес, грипп) есть дополнительная липопротеидная оболочка – суперкапсид, которая возникает из плазматической мембраны клетки-хозяина.

Рис. 3. Строение вируса
Вирусы не способны к самостоятельной жизнедеятельности. Они могут проявлять свойства живого, только попав в клетку-хозяина. Они используют потенциал и энергию этой клетки для создания своих новых вирусных частиц, следовательно, вирусы являются внутриклеточными паразитами.
Обычно вирус связывается с поверхностью клетки-хозяина и проникает внутрь. Каждый вирус ищет своего хозяина, то есть клетки строго определенного вида. Например, вирус – возбудитель гепатита (желтуха) проникает и размножается только в клетках печени, а вирус эпидемического паротита (свинка) – только в клетках околоушных слюнных желез человека.
Проникнув внутрь клетки-хозяина, вирусная ДНК или РНК начинает взаимодействовать с ее генетическим аппаратом таким образом, что клетка начинает синтезировать белки, свойственные вирусу (см. Рис. 4).

Рис. 4. Схема репродукции вируса
В дальнейшем пораженная вирусами клетка может буквально «лопнуть», и из нее выйдет большое число вирусных частиц. Иногда вирусы выделяются из клетки постепенно, по одному, и зараженная клетка живет долго – такой тип взаимодействия вируса с клеткой называется продуктивным.
При заражении ретровирусом (например, вирус иммунодефицита человека (ВИЧ)), у которого в качестве генетического материала используется молекула РНК, наблюдается другая картина. При попадании ретровируса в клетку-хозяина происходит обратная транскрипция. То есть на основе вирусной РНК синтезируется вирусная ДНК, которая встраивается в ДНК человека. Такой тип взаимодействия вируса с клеткой называется интегративным, а встроенная в состав хромосомы клетки ДНК вируса называется провирусом. Далее провирус реплицируется (удваивается) в составе хромосомы и переходит в геном дочерних клеток. Однако под влиянием некоторых физических и химических факторов провирус может выщепляться из хромосомы клетки и переходить к продуктивному типу взаимодействия, то есть синтезировать новые вирусные частицы.
При заражении ВИЧ человек чувствует себя здоровым, пока вирусный генетический материал встроен в хромосому человека. Однако при выщеплении этого вирусного генетического материала из клетки она начинает образовывать новые вирусные частицы, вследствие чего развивается смертельное заболевание – синдром приобретенного иммунодефицита (СПИД).
Вирусы являются возбудителями большого количества заболеваний человека: корь, грипп, оспа, краснуха, энцефалит, свинка, гепатиты, СПИД. Известен также целый ряд заболеваний растений, вызываемых вирусами, например мозаичная болезнь табака, томатов, огурцов или скручивание листьев картофеля. Всего описано около 500 видов вирусов, поражающих клетки позвоночных животных, и около 300 вирусов растений. Некоторые вирусы участвуют в злокачественном перерождении клеток и тем самым провоцируют онкологические заболевания.
В зависимости от содержащегося генетического материала вирусы подразделяются на ДНК-содержащие и РНК-содержащие.
РНК-содержащие вирусы
Одноцепочные РНК-содержащие вирусы подразделяются на:
1. Плюс-нитевые (положительные). Плюс-нить РНК этих вирусов выполняет наследственную (геномную) функцию и функцию информационной РНК (иРНК).
2. Минус-нитевые (отрицательные). Минус-нить РНК этих вирусов выполняет только наследственную функцию.
К РНК-содержащим вирусам относятся более  вирусов, вызывающих респираторные заболевания, а также вирус гриппа, кори, краснухи, свинки, ВИЧ. Также существует специфическая группа вирусов – арбовирусы, которые переносятся членистоногими.
вирусов, вызывающих респираторные заболевания, а также вирус гриппа, кори, краснухи, свинки, ВИЧ. Также существует специфическая группа вирусов – арбовирусы, которые переносятся членистоногими.
ДНК-содержащие вирусы
Двухцепочные ДНК-содержащие вирусы вызывают такие заболевания, как папиллома человека или герпес, гепатит В (гепатит А и гепатит С вызывается РНК-содержащими вирусами).
ДНК-содержащие вирусы поражают также растения. Они вызывают, например, золотую мозаику бобов или полосатость у кукурузы.
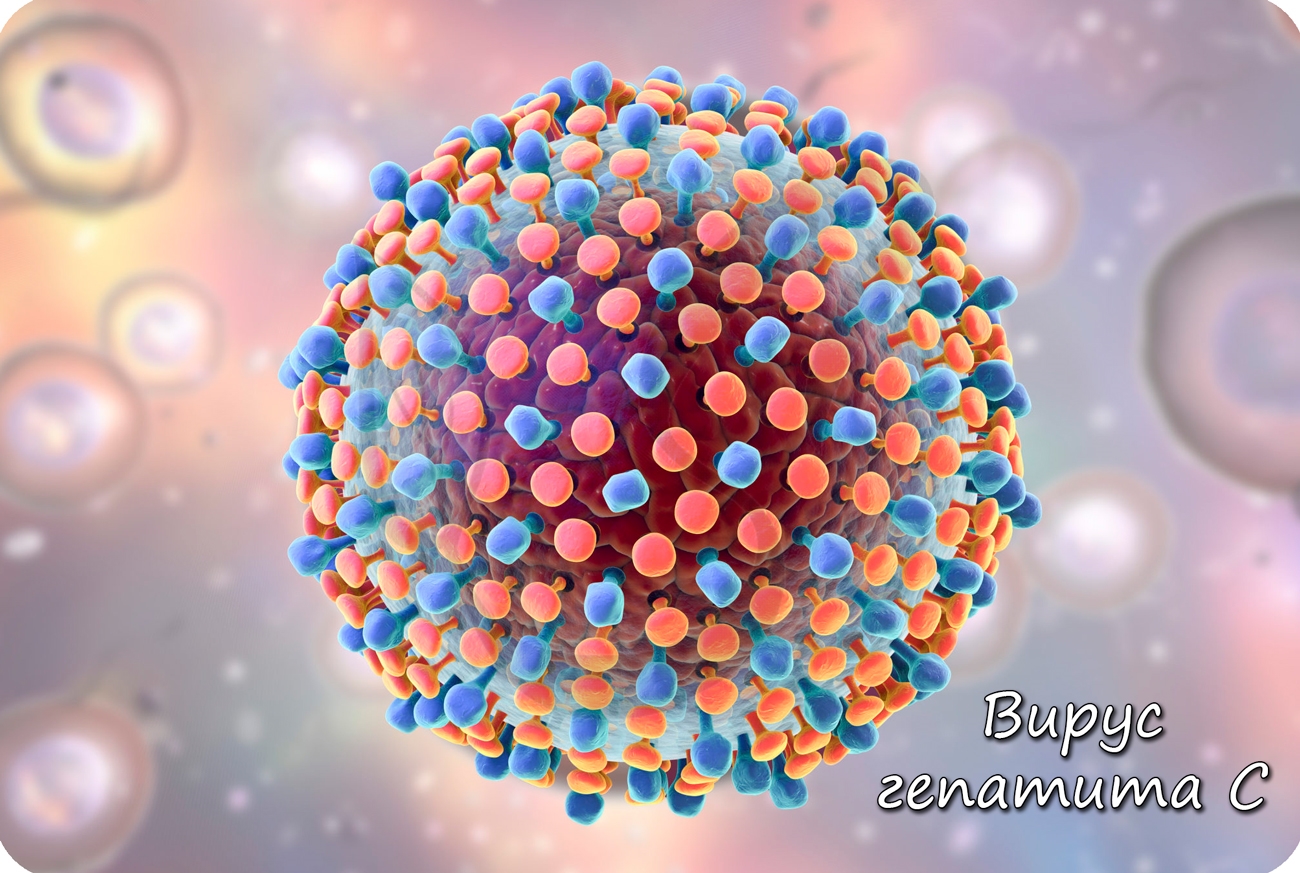
По своему строению вирус гепатита С – это РНК-содержащий вирус, имеющий сферическую форму, сложно устроенный (см. Рис. 5).
В качестве генетического материала такой вирус содержит линейную однонитчатую молекулу РНК.

Рис. 5. Гепатит С
Врачи называют гепатит С «ласковым убийцей», так как у этой болезни практически полностью отсутствуют симптомы. По причине бессимптомного течения болезни, диагностировать ее очень сложно: как правило, многие пациенты узнают о том, что заражены этим вирусом, совершенно случайно, к примеру, на плановых обследованиях. Ласковый убийца умело маскируется под другие недуги, которые сопровождаются слабостью, быстрой утомляемостью или астенией. Коварный гепатит C может на протяжении нескольких лет разрушать печень человека, не давая ему при этом возможности начать эффективное своевременное лечение. При переходе в хроническую стадию инфекции гепатит становится причиной цирроза или онкологических патологий печени.
Вопреки бытующим предрассудкам, подцепить вирус гепатита C невозможно через социальные контакты (поцелуи, объятия), через продукты или воду, через грудное молоко. Вы ничем не рискнете, если разделите с носителем вируса трапезу или напитки. Заразиться гепатитом C можно при контакте с кровью инфицированного человека либо половым путем.
В настоящее время для лечения гепатита С используют два препарата: Интерферон альфа и Рибавирин.

Рис. 6. Бактериофаг (Источник)
Особую группу вирусов составляют бактериофаги (или просто фаги), которые заражают бактериальные клетки (см. Рис. 6). Фаг укрепляется на поверхности бактерии при помощи специальных ножек и вводит в ее цитоплазму полый стержень, через который проталкивает внутрь клетки свою ДНК или РНК. Таким образом, генетический материал фага попадает внутрь бактериальной клетки, а капсид остается снаружи. В цитоплазме начинается репликация генетического материала фага, синтез его белков, построение капсида и сборка новых фагов. Уже через 10 мин после заражения в бактерии формируются новые фаги, а через полчаса бактериальная клетка разрушается, и из нее выходят около 200 заново сформированных вирусов – фагов, способных заражать другие бактериальные клетки (см. Рис. 7). Некоторые фаги используются человеком для борьбы с болезнетворными бактериями, вызывающими холеру, дизентерию, брюшной тиф.

Рис. 7. Схема размножения бактериофага (Источник)
Список литературы
- Каменский А.А., Криксунов Е.А., Пасечник В.В. Общая биология 10-11 класс Дрофа, 2005.
- Биология. 10 класс. Общая биология. Базовый уровень / П.В. Ижевский, О.А. Корнилова, Т.Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
- Беляев Д.К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
- Агафонова И.Б., Захарова Е.Т., Сивоглазов В.И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Biouroki.ru (Источник).
- Bio-faq.ru (Источник).
- School188spb.narod.ru (Источник).
- Neobio.ru (Источник).
Домашнее задание
- Вопросы в конце параграфа 20 (стр. 81) – Каменский А.А., Криксунов Е.А., Пасечник В.В. «Общая биология», 10-11 класс (Источник)
- Когда вирусы проявляют свойства живых организмов?
- Кто открыл вирусы?
Бактериофаги — Википедия
| Группа вирусов | |
|---|---|
 Структура типичного миовируса бактериофага. | |
| Бактериофаги | |
| не определён | |
| Домен Вирусы | |
Все вирусы, поражающие бактерий | |
Бактериофа́ги, или фа́ги (от др.-греч. φᾰγω «пожираю») — вирусы, избирательно поражающие бактериальные клетки и клетки архей. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их лизис. Как правило, бактериофаг состоит из белковой оболочки и генетического материала одноцепочечной или двуцепочечной нуклеиновой кислоты (ДНК или, реже, РНК). Общая численность бактериофагов в природе примерно равна общей численности бактерий (1030{\displaystyle 10^{30}} — 1032{\displaystyle 10^{32}} частиц)[1]. Бактериофаги активно участвуют в круговороте химических веществ и энергии, оказывают заметное влияние на эволюцию микробов и бактерий[1].
Английский бактериолог Фредерик Туорт в статье 1915 года описал инфекционную болезнь стафилококков, возбудитель которой проходил через фильтры, и его можно было переносить от одной колонии к другой.
Независимо от Фредерика Туорта французско-канадский микробиолог Феликс Д’Эрелль 3 сентября 1917 года сообщил об открытии бактериофагов.[2] Наряду с этим известно, что российский микробиолог Николай Фёдорович Гамалея ещё в 1897 году впервые наблюдал явление лизиса бактерий (сибиреязвенной палочки) под влиянием перевиваемого агента[3][4].
После открытия явлений бактериофагии Д’Эрелль развил учение о том, что бактериофаги патогенных бактерий, являясь их паразитами, играют большую роль в патогенезе инфекций, обеспечивая выздоровление больного организма, а затем создания специфического иммунитета. Это положение привлекло к явлению бактериофагии внимание многих исследователей, которые предполагали найти в фагах важное средство борьбы с наиболее опасными инфекционными болезнями человека и животных.
Также Феликс Д’Эрелль выдвинул предположение, что бактериофаги имеют корпускулярную природу. Однако только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представления о морфологии и основных особенностях фагов основывались на результатах изучения фагов группы Т — Т1, Т2,…, Т7, которые размножаются на Е. coli штамма B. Однако с каждым годом появлялись новые данные, касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.
 Бактериофаг ϕpp2 патогенных вибрионов V. parahaemolyticus
Бактериофаг ϕpp2 патогенных вибрионов V. parahaemolyticusи V. alginolyticus
Бактериофаги представляют собой наиболее многочисленную, широко распространённую в биосфере и, предположительно, наиболее эволюционно древнюю группу вирусов[5][6]. Приблизительный размер популяции фагов составляет более 1030 фаговых частиц[7].
В природных условиях фаги встречаются в тех местах, где есть чувствительные к ним бактерии. Чем богаче тот или иной субстрат (почва, выделения человека и животных, вода и т. д.) микроорганизмами, тем в большем количестве в нём встречаются соответствующие фаги. Так, фаги, лизирующие клетки всех видов почвенных микроорганизмов, находятся в почвах. Особенно богаты фагами чернозёмы и почвы, в которые вносились органические удобрения.
Бактериофаги выполняют важную роль в контроле численности микробных популяций, в автолизе стареющих клеток, в переносе бактериальных генов, выступая в качестве векторных «систем»[8].
Действительно, бактериофаги представляют собой один из основных подвижных генетических элементов. Посредством трансдукции они привносят в бактериальный геном новые гены. Было подсчитано, что за 1 секунду могут быть инфицированы 1024 бактерий[9]. Это означает, что постоянный перенос генетического материала распределяется между бактериями, обитающими в сходных условиях.
Высокий уровень специализации, долгосрочное существование, способность быстро репродуцироваться в соответствующем хозяине способствует их сохранению в динамичном балансе среди широкого разнообразия видов бактерий в любой природной экосистеме. Когда подходящий хозяин отсутствует, многие фаги могут сохранять способность к инфицированию на протяжении десятилетий, если не будут уничтожены экстремальными веществами либо условиями внешней среды[10].
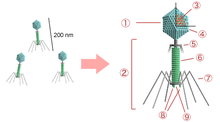 1 — головка, 2 — хвост, 3 — нуклеиновая кислота, 4 — капсид, 5 — «воротничок», 6 — белковый чехол хвоста, 7 — фибрилла хвоста, 8 — шипы, 9 — базальная пластинка
1 — головка, 2 — хвост, 3 — нуклеиновая кислота, 4 — капсид, 5 — «воротничок», 6 — белковый чехол хвоста, 7 — фибрилла хвоста, 8 — шипы, 9 — базальная пластинкаБактериофаги различаются по химической структуре, типу нуклеиновой кислоты, морфологии и характеру взаимодействия с бактериями. По размеру бактериальные вирусы в сотни и тысячи раз меньше микробных клеток.
Типичная фаговая частица (вирион) состоит из головки и хвоста. Длина хвоста обычно в 2—4 раза больше диаметра головки. В головке содержится генетический материал — одноцепочечная или двуцепочечная РНК или ДНК с ферментом транскриптазой в неактивном состоянии, окружённая белковой или липопротеиновой оболочкой — капсидом, сохраняющим геном вне клетки[11].
Нуклеиновая кислота и капсид вместе составляют нуклеокапсид. Бактериофаги могут иметь икосаэдральный капсид, собранный из множества копий одного или двух специфичных белков. Обычно углы состоят из пентамеров белка, а опора каждой стороны из гексамеров того же или сходного белка. Более того, фаги по форме могут быть сферические, лимоновидные или плеоморфные[12].
Хвост, или отросток, представляет собой белковую трубку — продолжение белковой оболочки головки, в основании хвоста имеется АТФаза, которая регенерирует энергию для инъекции генетического материала. Существуют также бактериофаги с коротким отростком, не имеющие отростка и нитевидные[13].
Головка округлой, гексагональной или палочковидной формы диаметром 45—140 нм. Отросток толщиной 10—40 и длиной 100—200 нм. Одни из бактериофагов округлы, другие нитевидны, размером 8×800 нм. Длина нити нуклеиновой кислоты во много раз превышает размер головки, в которой находится в скрученном состоянии, и достигает 60—70 мкм. Отросток имеет вид полой трубки, окружённой чехлом, содержащим сократительные белки, подобные мышечным. У ряда вирусов чехол способен сокращаться, обнажая часть стержня. На конце отростка у многих бактериофагов имеется базальная пластинка, от которой отходят тонкие длинные нити, способствующие прикреплению фага к бактерии. Общее количество белка в частице фага — 50-60%, нуклеиновых кислот — 40-50%.[14]
Фаги, как и все вирусы, являются абсолютными внутриклеточными паразитами. Хотя они содержат всю информацию для запуска собственной репродукции в соответствующем хозяине, у них нет механизмов для выработки энергии и рибосом для синтеза белка. Размер известных фаговых геномов варьирует от нескольких тысяч до 498 тысяч пар оснований (геном фага G, поражающего бацилл)[15][16].
Большое количество выделенных и изученных бактериофагов определяет необходимость их систематизации. Этим занимается Международный комитет по таксономии вирусов (ICTV). В настоящее время, согласно Международной классификации и номенклатуре вирусов, бактериофаги разделяют в зависимости от типа нуклеиновой кислоты и морфологии.
На данный момент выделяют девятнадцать семейств. Из них только два РНК-содержащих и только пять семейств имеют оболочку. Из семейств ДНК-содержащих вирусов только два семейства имеют одноцепочечные геномы. У девяти ДНК-содержащих семейств геном представлен кольцевой ДНК, а у других девяти — линейной. Девять семейств специфичны только для бактерий, остальные девять только для архей, а (Tectiviridae) инфицирует как бактерий, так и архей[17].
| Порядок | Семейство | Морфология | Нуклеиновая кислота | Пример |
|---|---|---|---|---|
| Caudovirales | Myoviridae | Без оболочки, сократительный хвост | Линейная дцДНК | Фаг Т4, фаг μ, PBSX, P1Puna-like, P2, I3, Bcep 1, Bcep 43, Bcep 78 |
| Siphoviridae | Без оболочки, несократительный хвост (длинный) | Линейная дцДНК | Фаг λ, фаг T5, C2, L5, HK97, N15 | |
| Podoviridae | Без оболочки, несократительный хвост (короткий) | Линейная дцДНК | Фаг T7, фаг T3, P22, P37 | |
| Ligamenvirales | Lipothrixviridae | В оболочке, палочкообразные | Линейная дцДНК | Acidianus filamentous virus 1—3, 6—9 |
| Rudiviridae | Без оболочки, палочкообразные | Линейная дцДНК | Sulfolobus islandicus rod-shaped virus 1, 2 | |
| Неизвестен | Ampullaviridae | В оболочке, бутылкообразные | Линейная дцДНК | |
| Bicaudaviridae | Без оболочки, лемонообразные | Кольцевая дцДНК | ||
| Clavaviridae | Без оболочки, палочкообразные | Кольцевая дцДНК | ||
| Corticoviridae | Без оболочки, изометрические | Кольцевая дцДНК | ||
| Cystoviridae | В оболочке, сферические | Сегментированная дцРНК | ||
| Fuselloviridae | Без оболочки, лемонообразные | Кольцевая дцДНК | ||
| Globuloviridae | В оболочке, изометрические | Линейная дцДНК | ||
| Guttaviridae | Без оболочки, яйцевидные | Кольцевая дцДНК | ||
| Inoviridae | Без оболочки, нитевидные | Кольцевая оцДНК | M13 | |
| Leviviridae | Без оболочки, изометрические | Линейная оцРНК | MS2, Qβ | |
| Microviridae | Без оболочки, изометрические | Кольцевая оцДНК | ΦX174 | |
| Plasmaviridae | В оболочке, плеоморфные | Кольцевая дцДНК | ||
| Tectiviridae | Без оболочки, изометрические | Линейная дцДНК |
Взаимодействие бактериофага с бактериальными клетками[править | править код]
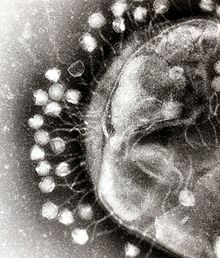 Адсорбция бактериофагов на поверхности бактериальной клетки
Адсорбция бактериофагов на поверхности бактериальной клеткиПо характеру взаимодействия бактериофага с бактериальной клеткой различают вирулентные и умеренные фаги[13]. Вирулентные фаги могут только увеличиваться в количестве посредством литического цикла[10]. Процесс взаимодействия вирулентного бактериофага с клеткой складывается из нескольких стадий: адсорбции бактериофага на клетке, проникновения в клетку, биосинтеза компонентов фага и их сборки, выхода бактериофагов из клетки[9][19].
Первоначально бактериофаги прикрепляются к фагоспецифическим рецепторам на поверхности бактериальной клетки. Хвост фага с помощью ферментов, находящихся на его конце (в основном лизоцима), локально растворяет оболочку клетки, сокращается и содержащаяся в головке ДНК инъецируется в клетку, при этом белковая оболочка бактериофага остаётся снаружи. Инъецированная ДНК вызывает полную перестройку метаболизма клетки: прекращается синтез бактериальной ДНК, РНК и белков. ДНК бактериофага начинает транскрибироваться с помощью собственного фермента транскриптазы, который после попадания в бактериальную клетку активируется. Синтезируются сначала ранние, а затем поздние иРНК, которые поступают на рибосомы клетки-хозяина, где синтезируются ранние (ДНК-полимеразы, нуклеазы) и поздние (белки капсида и хвостового отростка, ферменты лизоцим, АТФаза и транскриптаза) белки бактериофага. Репликация ДНК бактериофага происходит по полуконсервативному механизму и осуществляется с участием собственных ДНК-полимераз. После синтеза поздних белков и завершения репликации ДНК наступает заключительный процесс — созревание фаговых частиц или соединение фаговой ДНК с белком оболочки и образование зрелых инфекционных фаговых частиц[20].
Продолжительность этого процесса может составлять от нескольких минут до нескольких часов[10]. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги[13]. Иногда фаг инициирует литический цикл, что приводит к лизису клетки и освобождению новых фагов. В качестве альтернативы фаг может инициировать лизогенный цикл, при котором он вместо репликации обратимо взаимодействует с генетической системой клетки-хозяина, интегрируясь в хромосому или сохраняясь в виде плазмиды[10]. Таким образом, вирусный геном реплицируется синхронно с ДНК хозяина и делением клетки, а подобное состояние фага называется профагом. Бактерия, содержащая профаг, становится лизогенной до тех пор, пока при определённых условиях или спонтанно профаг не будет стимулирован на осуществление лизирующего цикла репликации. Переход от лизогении к лизису называется лизогенной индукцией или индукцией профага. На индукцию фаг оказывает сильное воздействие состояние клетки хозяина предшествующее индукции, также как наличие питательных веществ и другие условия, имеющие место в момент индукции. Скудные условия для роста способствуют лизогенному пути, тогда как хорошие условия способствуют литической реакции[10][13][20].
Очень важным свойством бактериофагов является их специфичность: бактериофаги лизируют культуры определённого вида, более того, существуют так называемые типовые бактериофаги, лизирующие варианты внутри вида, хотя встречаются поливалентные бактериофаги, которые паразитируют в бактериях разных видов[21][22].
Умеренные и вирулентные бактериофаги на начальных этапах взаимодействия с бактериальной клеткой имеют одинаковый цикл.
- Адсорбция бактериофага на фагоспецифических рецепторах клетки.
- Инъекция фаговой нуклеиновой кислоты в клетку хозяина.
- Совместная репликация фаговой и бактериальной нуклеиновой кислоты.
- Деление клетки.
- Далее бактериофаг может развиваться по двум моделям: лизогенный либо литический путь.
- Умеренные бактериофаги после деления клетки находятся в состоянии профага (лизогенный путь).
- Вирулентные бактериофаги развиваются по литической модели:
- Нуклеиновая кислота фага направляет синтез ферментов фага, используя для этого белоксинтезирующий аппарат бактерии. Фаг тем или иным способом инактивирует ДНК и РНК хозяина, а ферменты фага совсем расщепляют её; РНК фага «подчиняет» себе клеточный аппарат синтеза белка.
- Нуклеиновая кислота фага реплицируется и направляет синтез новых белков оболочки. Образуются новые частицы фага в результате спонтанной самосборки белковой оболочки (капсид) вокруг фаговой нуклеиновой кислоты; под контролем РНК фага синтезируется лизоцим.
- Лизис клетки: клетка лопается под воздействием лизоцима; высвобождается около 200—1000 новых фагов; фаги инфицируют другие бактерии.
В медицине[править | править код]
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие. В России зарегистрировано и применяется 13 медицинских препаратов на основе фагов[1]. В настоящее время их применяют для лечения бактериальных инфекций, которые не чувствительны к традиционному лечению антибиотиками, особенно в республике Грузия[23][24][25]. Обычно, применение бактериофагов сопровождается большим, чем антибиотики, успехом там, где присутствуют биологические мембраны, покрытые полисахаридами, через которые антибиотики обычно не проникают[26]. В настоящее время терапевтическое применение бактериофагов не получило одобрения на Западе, хотя и применяются фаги для уничтожения бактерий, вызывающих пищевые отравления, таких, как листерии[27].В России терапевтические фаговые препараты делают давно, фагами лечили ещё до антибиотиков. В последние годы фаги широко использовали после наводнений в Крымске[28] и Хабаровске, чтобы предотвратить дизентерию.
В биологии[править | править код]
Бактериофаги применяются в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
Фаговые векторы обычно создают на базе умеренного бактериофага λ, содержащего двухцепочечную линейную молекулу ДНК. Левое и правое плечи фага имеют все гены, необходимые для литического цикла (репликации, размножения). Средняя часть генома бактериофага λ (содержит гены, контролирующие лизогению, то есть его интеграцию в ДНК бактериальной клетки) не существенна для его размножения и составляет примерно 25 тысяч пар нуклеотидов. Данная часть может быть заменена на чужеродный фрагмент ДНК. Такие модифицированные фаги проходят литический цикл, но лизогения не происходит. Векторы на основе бактериофага λ используют для клонирования фрагментов ДНК эукариот (то есть более крупных генов) размером до 23 тысяч пар нуклеотидов (т. п. н.). Причём, фаги без вставок — менее 38 т. п. н. или, напротив, со слишком большими вставками — более 52 т. п. н. не развиваются и не поражают бактерии[29].
Бактериофаги M13, фаг Т4, T7 и фаг λ используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея.
Поскольку размножение бактериофага возможно только в живых клетках, бактериофаги могут быть использованы для определения жизнеспособности бактерий. Данное направление имеет большие перспективы, поскольку, одним из основных вопросов при разных биотехнологических процессах является определение жизнеспособности используемых культур. С помощью метода электрооптического анализа клеточных суспензий была показана возможность изучения этапов взаимодействия фаг-микробная клетка[30].
- ↑ 1 2 3 Сергей Головин Бактериофаги: убийцы в роли спасителей // Наука и жизнь. — 2017. — № 6. — С. 26-33
- ↑ Félix d’Hérelles. Sur un microbe invisible antagoniste des bacilles dysentériques (фр.) // Comptes rendus Acad Sci Paris. : magazine. — 1917. — Vol. 165. — P. 373—375. Архивировано 4 декабря 2010 года.
- ↑ Вирусы бактерий
- ↑ Бактериофаг (неопр.) (недоступная ссылка). Дата обращения 24 июня 2011. Архивировано 21 ноября 2013 года.
- ↑ Ackermann H.-W. // Res. Microbiol., 2003. — V. 154. — P. 245—251
- ↑ Hendrix R.W. // Theor. Popul. Biol., 2002. — V. 61. — P. 471—480
- ↑ Suttle C.A. (September 2005), Vuiruses in the sea. Nature 437:356-361.
- ↑ Шестаков С. В. Как происходит и чем лимитируется горизонтальный перенос генов у бактерий. Экологическая генетика 2007. — Т. 5. — № 2. — C. 12-24.
- ↑ 1 2 Tettelin H., Masignani V., Cieslewicz M. J., Donati C., Medini D., Ward N. L., Angiuoli S. V., Crabtree J., Jones A. L., Durkin A. S., Deboy R. T., Davidsen T. M., Mora M., Scarselli M., Margarit y Ros I., Peterson J. D., Hauser C. R., Sundaram J. P., Nelson W. C., Madupu R., Brinkac L. M., Dodson R. J., Rosovitz M. J., Sullivan S. A., Daugherty S. C., Haft D. H., Selengut J., Gwinn M. L., Zhou L., Zafar N., Khouri H., Radune D., Dimitrov G., Watkins K., O’Connor K. J., Smith S., Utterback T. R., White O., Rubens C. E., Grandi G., Madoff L. C., Kasper D. L., Telford J. L.,. Wessels M. R, Rappuoli R., Fraser C. M. Genome analysis of multiple pathogenic isolates of Streptococcus agalactiae: implications for the microbial «pan-genome.» Proc. Natl. Acad. Sci. USA 2005. 102: 13950-13955 (неопр.) (недоступная ссылка). Дата обращения 24 июня 2011. Архивировано 29 декабря 2010 года.
- ↑ 1 2 3 4 5 Guttman B., Raya R., Kutter E. Basic Phage Biology, in Bacteriophages: Biology and Applications, (Kutter E. and Sulakvelidze A., ed.), CRP Press, 2005 FL. — P. 29-66.
- ↑ Ковалёва Е. Н. Создание биопрепарата на основе выделенных и изученных бактериофагов Enterococcus faecalis: Дис. … канд. биол. наук. — Саратов, 2009. — 151 с.
- ↑ Ackermann H.-W. // Res. Microbiol., 2003. — V. 154. — P. 245—251.
- ↑ 1 2 3 4 Ожерельева Н. Г. Краткая Медицинская Энциклопедия, М.: изд-во «Советская Энциклопедия», 1989. — издание второе.
- ↑ Бактериофаги // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ Molecular Medical Microbiology / Yi-Wei Tang, Max Sussman, Dongyou Liu, Ian Poxton, Joseph Schwartzman. — 2 ed. — Academic Press, 2014. — Vol. 1. — P. 579. — 2216 p. — ISBN 9780123977632.
- ↑ Bacillus phage G, complete genome (неопр.). GenBank.
- ↑ Virus Taxonomy. Classification and Nomenclature of Viruses. Seventh Report of the International Committee on Taxonomy of Viruses / Edited by M. H. V. van Regenmontel et al. — San Diego: Academic Press, 2000. — P. 43—53, 64—129.
- ↑ Mc Grath S and van Sinderen D (editors). Bacteriophage: Genetics and Molecular Biology (англ.). — 1st. — Caister Academic Press (англ.)русск., 2007. — ISBN 978-1-904455-14-1.
- ↑ Raya R.R., Hébert E.M. Isolation of phage via induction of lysogens. Bacteriophages: Methods and Protocols, Volume 1: Isolation, Characterization, and Interaction (Martha R.J. Clokie, Andrew M. Kropinski (eds.), 2009. — V. 501. — P. 23-32.
- ↑ 1 2 Микробиология: учеб. пособие / В. В. Лысак. — Минск: БГУ, 2007. — 430 с.
- ↑ Адамс М. Бактериофаги / М. Адамс. — М.: Медгиз, 1961. — 521 с.
- ↑ Гольдфарб Д. М., Бактериофагия / Д. М. Гольдфарб. — М.: Медгиз, 1961. — 299 с.
- ↑ BBC Horizon: Phage — The Virus that Cures 1997-10-09
- ↑ Parfitt T. Georgia: an unlikely stronghold for bacteriophage therapy (англ.) // The Lancet : journal. — Elsevier, 2005. — Vol. 365, no. 9478. — P. 2166—2167. — doi:10.1016/S0140-6736(05)66759-1. — PMID 15986542.
- ↑ Thiel, Karl. Old dogma, new tricks—21st Century phage therapy (англ.) // Nature Biotechnology. — London UK: Nature Publishing Group, 2004. — January (vol. 22, no. 1). — P. 31—36. — doi:10.1038/nbt0104-31. — PMID 14704699.
- ↑ Aguita, Maria. Combatting Bacterial Infection, LabNews.co.uk. Архивировано 28 февраля 2009 года. Дата обращения 5 мая 2009.
- ↑ Pirisi A. Phage therapy—advantages over antibiotics? (англ.) // The Lancet. — Elsevier, 2000. — Vol. 356, no. 9239. — P. 1418. — doi:10.1016/S0140-6736(05)74059-9. — PMID 11052592.
- ↑ Все юные жители Крымска привиты от гепатита A | РИА ФедералПресс
- ↑ Щелкунов С. Н. Генетическая инженерия / С. Н. Щелкунов. — Новосибирск: Сиб. унив. изд-во, 2004. — 496 с.
- ↑ Guliy O.I., Bunin V.D., O’Neil D., Ivnitski D., Ignatov O.V. A new electro-optical approach to rapid assay of cell viability // Biosensors and Bioelectronics. 2007. V. 23. P. 583—587.
Вирусы, подготовка к ЕГЭ по биологии
Вирус (лат. virus — яд) — неклеточная форма жизни, мельчайшие болезнетворные микроорганизмы, не видимые в микроскоп. Они значительно меньше бактерий: легко проходят через бактериальные фильтры.
Вирусы способны размножаться только внутри живых клеток, до проникновения в них вирусы не имеют признаков жизни: пассивно перемещаются во внешней среде, ожидая встречи с клеткой-мишенью.
В 1892 году Ивановский Д.И. в ходе изучения мозаичной болезни табака обнаружил, что болезнь вызывается мельчайшими субстанциями, которые проходят через бактериальный фильтр, то есть были меньше бактерий. Вирусы впервые увидели в электронный микроскоп в 1939 году (спустя 19 лет со смерти Ивановского), однако считается, что именно Ивановский положил начало вирусологии как науке.

Вирусы выделяют в отдельное, пятое царство. Несмотря на их кажущуюся безжизненность, от неживой материи их отличают следующие черты:
- Наличие наследственности и изменчивости
- Способность к репродукции (воспроизведению себе подобных)
Рекомендую обратить особое внимание на черты, которые отличают вирусы от живых организмов:
- Неживое (инертное) состояние
- Обмен веществ
- Неклеточное строение
- Не делятся, не размножаются половым путем
- Не растут
Вне клетки хозяина находятся в неживом состоянии, ожидая внедрения. Вирусы — облигатные внутриклеточные паразиты.
У вирусов отсутствует обмен веществ с внешней средой (метаболизм).
Не имеют клеточной мембраны, ограничивающих их от внешней среды, и, соответственно, клеточного строения.
У вирусов отсутствует половое размножение и деление. Попав в живую клетку, вирус встраивает свою нуклеиновую кислоту (РНК/ДНК) в наследственный материал клетки-мишени. В результате клетка начинает синтезировать вирусные белки (новые вирусы): так увеличивается численность вирусов.
Вирусы не растут, не увеличиваются в размерах. Стратегия их жизни — безудержное размножение.
Если мы заглянем в клетку, инфицированную вирусом, то от вируса мы увидим только один элемент — его нуклеиновую кислоту (ДНК/РНК). Во внешней среде вирусы существуют в виде вирионов — полностью сформированных вирусных частиц, состоящих из белковой оболочки (капсида) и нуклеиновой кислоты внутри.
Носителем наследственной информации у вирусов может быть ДНК, РНК. В связи с этим все вирусы подразделяются на ДНК- и РНК-содержащие.
Взаимодействие вируса с клеткой
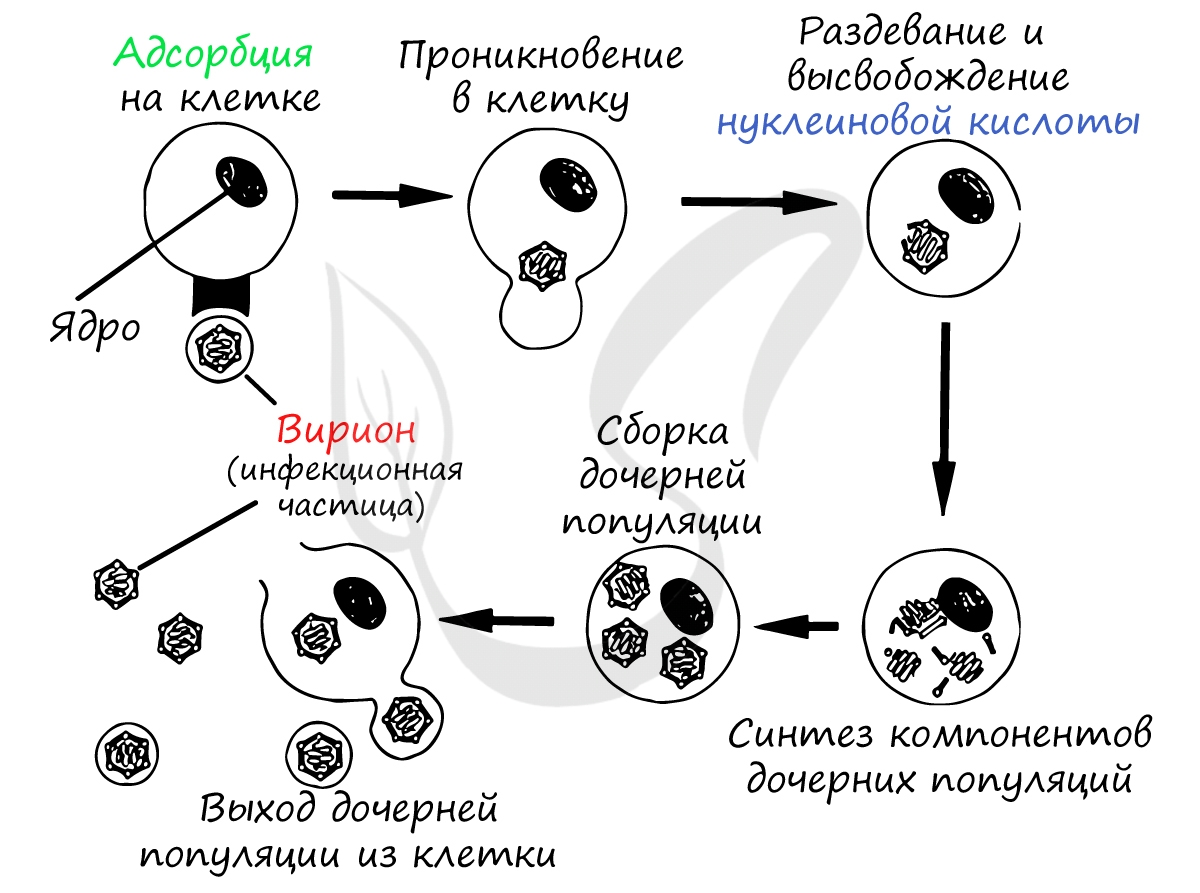
Найдя клетку, на поверхности которой есть подходящий рецептор, вирус взаимодействует с ним и прикрепляется к мембране клетки. Путем эндоцитоза (образование вакуоли) вирус проникает внутрь клетки, выходит из вакуоли в цитоплазму. Наследственный материал (ДНК/РНК) вируса реализуется по схеме: ДНК ↔ РНК → белок.
Проникнув внутрь клетки (инфицировав ее), вирус реализует собственный генетический материал (ДНК/РНК) путем синтеза вирусного белка на рибосомах клетки хозяина. Клетка даже и не подозревает, что вирус встроил в ее РНК/ДНК свой генетический код — она принимает его как свой собственный, а в результате синтезирует вирусные белки.
Образовавшиеся белки объединяются в вирусные частицы, которые могут выходить из клетки разными путями. Вирионы вирусов гепатита C выходят из клетки путем почкования (экзоцитозом), при таком варианте клетка долгое время остается живой и служит для продукции новых вирионов.
Известен и другой механизм выхода вирионов из клетки: взрывной, при котором оболочка клетки разрывается, и тысячи вирионов отправляются инфицировать новые клетки. Такой способ характерен для аденовирусов, ротавирусов.
Бактериофаги («бактерия» + греч. phag(os) — пожирающий)
Это уникальная группа вирусов, инфицирующая только бактерии. Бактериофаг имеет капсид, с содержащимся внутри наследственным материалом — ДНК (реже РНК), протеиновым хвостом. Бактериофаги открыты в 1915 году и с тех пор активно применяются в ходе генетических исследований.
Ниже вы можете видеть типичное строение бактериофага. Бактериофаг напоминает шприц, который протыкает стенку бактерии и впрыскивает внутрь нее свою нуклеиновую кислоту.

Бактериофаги успешно применяются в медицине для лечения многих заболеваний. Это высокоэффективные, дорогостоящие препараты, которые помогают, например, нормализовать микрофлору кишечника при бактериальных инфекциях.
Вирусные инфекции
Вирусы вызывают множество заболеваний человека и животных. Некоторые из них неизлечимы даже на современном этапе развития медицины, например бешенство. К вирусным инфекциям относятся грипп, корь, свинка, СПИД (вызванный ВИЧ), полиомиелит, желтая лихорадка, онковирусы.
Такая группа, как онковирусы, потенцируют развитие опухолей в организме. К ВИЧ и онкогенным вирусам не существует специфических антител, что затрудняет процесс создания вакцины. В то же время против ряда вирусных инфекций: корь, ветряная оспа созданы вакцины, создающие стойкий пожизненный иммунитет.
Клетки вырабатывают защитный белок — интерферон. Это вещество подавляет синтез новых вирусных частиц, приводит к повышению температуры тела (например, при гриппе).

Вирус иммунодефицита человека (ВИЧ) представляет для организма большую опасность. Он размножается в T-лимфоцитах — клетках крови, которые выполняют иммунную функцию. С гибелью T-лимфоцитов разрушается иммунная система, становится невозможным сопротивление организма бактериями, вирусам и грибам, что в отсутствии лечения приводит к вторичным инфекциям.
Риск заражения ВИЧ присутствует при гемотрансфузии (переливании крови), половом акте. Инфекция также может быть передана от ВИЧ инфицированной матери к плоду.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Грибы, вирусы, бактерии
Справка: любые живые организмы, невидимые человеческим глазом (т.е. меньше 0,1 мм) называют микробами. Именно они становятся причиной различных инфекционных заболеваний.
Бактерии
Бактериями называют тех одноклеточных микроорганизмов, которые используют человека как… продукт питания, а заодно и среду для размножения. Они вызывают целый ряд заболеваний: как коклюш, столбняк, пневмонию, бронхит, дизентерию, гонорею, сифилис, туберкулез, менингит, холеру, чуму и многие другие. К счастью, в XX веке человечество научилось справляться с большинством из перечисленных болезней: был изобретен целый класс лекарственных средств – антибиотики, причем первый из них, получивший широкое признание – пенициллин G – был выделен их плесневого грибка пенициллиума, также относящегося к микроорганизмам. Вот так микробы помогли в борьбе с микробами! К сожалению, некоторые бактерии со временем становятся устойчивы к отдельным препаратам, что заставляет людей создавать все новые и новые виды эффективных лекарств.
Вирусы
Эта внеклеточная форма жизни находится на границе между живым и неживым. С одной стороны, вирусы, как и все живое на земле, имеют собственный набор генов. С другой – у них нет клеточной структуры, и они могут самовоспроизводиться, только внедрившись в здоровую клетку организма-«хозяина». Захватывая новые клетки, вирусы приводят к прогрессированию болезни; это может быть грипп, ОРЗ, герпес, вирусный гепатит, СПИД, корь, краснуха, ветряная оспа, клещевой энцефалит и другие. Поступлению вирусов в клетку и размножению в организме препятствуют противовирусные препараты различных групп, например, индукторы выработки интерферона (специального «противовирусного» белка). Следует помнить, что применение противовирусных препаратов наиболее эффективно в целях профилактики и на ранних стадиях заболевания.
«Антибактериальные препараты бессильны против вирусов. Однако нередко при гриппе и острых респираторных вирусных инфекциях пациентам назначают антибиотики, рассказывает Василий Афонюшкин, к.б.н., вирусолог (Новосибирск). – Это делается во избежание вторичных бактериальных осложнений, которые могут возникнуть на фоне вирусного заболевания из-за ослабления защитных свойств слизистых оболочек дыхательной системы. Безусловно, не следует применять антибиотики самостоятельно, без консультации с врачом, так как всегда есть риск развития антибиотикорезистентности, дисбиозов кишечника, гиповитаминозов, что способно нанести вред организму».
Грибы
Грибы имеют более сложное строение и являются одними из самых стойких микроорганизмов в нашем мире – для роста и развития им нужна только влага. Некоторые разновидности грибов, например, кандида, в обычных условиях живут на слизистой полости рта и в кишечнике человека, но при сбое иммунитета и нарушении микрофлоры могут вызвать местные инфекции кожи, влагалища или полости рта – эта болезнь называется кандидозом (молочницей). Стригущий лишай и многие поражения кожи, называемые дерматофитией, тоже вызываются грибами. Большинство инфекций развивается медленно и с трудом поддается лечению. Важно знать, что нерегулярный прием или преждевременное окончание терапии противогрибковыми средствами (антимикотиками) увеличивает риск рецидива заболевания.
Простейшие
Это уже полноценные организмы — животные-клетки, которые живут в организме человека и питаются окружающими клетками и микроорганизмами. Например, трихомонада (причина венерического заболевания трихомониоз) может поглощать бактерии гонококки и хламидии, а те, в свою очередь, сохраняют внутри трихомонад свою жизнеспособность. Именно поэтому такое сочетание инфекций плохо поддается лечению. Простейшие также становятся причинами лямблиоза, малярии, амебной дизентерии, сонной болезни и других. Возбудители чрезвычайно многообразны, поэтому для каждого заболевания приходилось искать свои средства борьбы. Когда-то от малярии спасались только корой хинного дерева, а сегодня класс противопротозойных препаратов включает множество различных по химической структуре соединений.
Грамотная и своевременно подобранная врачом терапия позволит избавиться от инфекционного заболевания, вызванного обитателями микромира, и не заработать неприятных осложнений.
Список источников:
Александрова В.А., Одинцева В.Е. Сравнительная характеристика диагностики и лечения гельминтно-протозойных инвазий у детей на современном этапе // Коллоквиум. № 8, 2010.
Покровский В.И. и др. Инфекционные болезни и эпидемиология. – М., 2007.
Смородинцев А.А., Кривинский А.С. Мир микробов. – М., 1952.
Шувалова Е.П. Инфекционные болезни. – М., 2001.
Автор Елена Носова
Фото istockphoto.com
Вирусы и бактерии – великое противостояние
Создание современной технологии геномного редактирования, которая уже с успехом применяется на разных животных, растениях, грибах и бактериях, базируется на исследованиях бактериальных систем CRISPR-Cas. Изначально предполагалось, что они участвуют в ликвидации повреждений бактериальной ДНК, но в 2007 г. стало ясно, что истинное предназначение этих систем – борьба с вирусами бактерий, бактериофагами. Всего за девять лет наука проделала гигантский путь от раскрытия механизма бактериального иммунитета до редактирования геномов людей – в настоящее время уже проводятся первые эксперименты по редактированию ДНК человеческих эмбрионов. У бактерий имеются и другие «иммунные» механизмы, изучение которых, возможно, создаст предпосылки для новых прорывов в биомедицине
Бактериофаги – это вирусы, которые поражают только бактерий. В ходе инфекции они влияют на все процессы жизнедеятельности бактериальной клетки, фактически превращая ее в фабрику по производству вирусного потомства. В конце концов клетка разрушается, а вновь образованные вирусные частицы выходят наружу и могут заражать новые бактерии.
Несмотря на огромное число и разнообразие природных фагов, встречаемся мы с ними редко. Однако бывают ситуации, когда деятельность этих вирусов не остается незамеченной. Например, на предприятиях, где производят сыры, йогурты и другие молочно-кислые продукты, часто приходится сталкиваться с вирусной атакой на бактерии, сбраживающие молоко. В большинстве таких случаев фаговая инфекция распространяется молниеносно, и полезные бактерии гибнут, что приводит к значительным экономическим потерям (Neve et al., 1994).
Именно благодаря прикладным исследованиям в интересах молочной промышленности, направленным на получение устойчивых к бактериофагам штаммов молочно-кислых бактерий, был открыт ряд механизмов, с помощью которых бактерии избегают инфекции. Параллельно были изучены способы, с помощью которых вирусы, в свою очередь, преодолевают бактериальные системы защиты (Moineau et al., 1993).
Кто защищен – тот вооружен
На сегодня известно пять основных, весьма хитроумных механизмов защиты, которые бактерии выработали в непрестанной борьбе с вирусами: изменение рецептора на поверхности клетки; исключение суперинфекции; системы абортивной инфекции; системы рестрикции-модификации и, наконец, системы CRISPR-Cas.
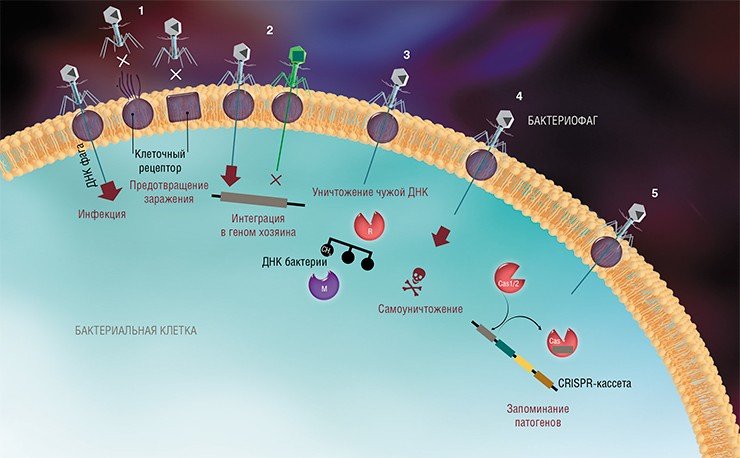
В ходе эволюции происходила и сейчас происходит селекция бактерий, способных избежать гибели при инфицировании вирусами, что, в свою очередь, служит стимулом для бактериофагов совершенствовать свои агрессивные стратегии. Эта «гонка вооружений», длящаяся несколько миллиардов лет, т. е. ровно столько, сколько существуют сами бактерии и их враги, породила целый ряд изощренных механизмов защиты и нападения
Вирусная атака начинается с прикрепления фага к специфическому рецептору на поверхности бактериальной клетки, но при потере рецептора или изменении в его структуре связывания вируса не происходит. Бактерии могут менять рецепторы в зависимости от окружающих условий, таких как плотность и разнообразие микроорганизмов в среде, а также доступность питательных веществ (Bikard et al., 2012). Любопытный пример — бактерии вида Vibrio anguillarum, которые способны формировать биопленку, т. е. плотный слой клеток, прикрепленный к какой-либо поверхности. У этой бактерии имеется своего рода «чувство кворума», за счет чего при увеличении плотности клеток у них понижается выработка рецептора, с которым может связываться вирус. В результате биопленка становится почти полностью устойчивой к заражению (Tan et al., 2015).
Однако потеря рецепторов не всегда выгодна для бактерии, поскольку они выполняют разнообразные важные функции, например, транспорт питательных веществ или формирование межклеточных контактов (Lopez-Pascua et al., 2008). В результате для каждой пары «бактерия-бактериофаг» в ходе эволюции находится оптимальное решение, обеспечивающее приемлемый уровень защиты при сохранении возможности роста бактерий в различных условиях среды.
Следующий защитный механизм – исключение суперинфекции. Для бактериофагов известны два основных пути инфекции: литический, приводящий к быстрой гибели зараженной бактерии с высвобождением вирусного потомства, и затяжной лизогенный путь, когда наследственный материал вируса находится внутри генома бактерии, удваивается только с хозяйской ДНК, не причиняя клетке вреда. Когда клетка находится в состоянии лизогенной инфекции, то, с точки зрения «домашнего» вируса (профага), ее заражение другим вирусом нежелательно.
Действительно, многие вирусы, встроившие свою ДНК в геном клетки, ограничивают вновь проникшего в клетку бактериофага («суперинфекцию») посредством специальных белков-репрессоров, не позволяющих генам «пришельца» работать (Calendar, 2006). А некоторые фаги даже препятствуют другим вирусным частицам проникнуть в инфицированную ими клетку, воздействуя на ее рецепторы. В результате бактерии – носительницы вируса имеют очевидное преимущество по сравнению с незараженными собратьями.
В 1978 г. за открытие ферментов рестриктаз швейцарский генетик В. Арбер и американские микробиологи Д. Натанс и Г. Смит были удостоены Нобелевской премии. Изучение систем рестрикции-модификации привело к созданию технологии молекулярного клонирования, которая широко применяется во всем мире. С помощью рестриктаз можно «вырезать» гены из генома одного организма и вставить в геном другого, получив химерную рекомбинантную ДНК, не существующую в природе. Различные вариации этого подхода используются учеными для изолирования отдельных генов и их дальнейшего изучения. Кроме того, он широко применяется в фармацевтике, например, для наработки инсулина или терапевтических антител: все лекарства такого рода созданы с помощью молекулярного клонирования, т. е. являются продуктом генной модификации
Во время инфекции все ресурсы бактериальной клетки направлены на производство новых вирусных частиц. Если рядом с такой клеткой будут находиться другие уязвимые бактерии, то инфекция быстро распространится и приведет к гибели большинства из них. Однако для таких случаев у бактерии имеются так называемые системы абортивной инфекции, которые приводят ее к запрограммированной гибели. Конечно, этот «альтруистичный» механизм не спасет саму зараженную клетку, но остановит распространение вирусной инфекции, что выгодно для всей популяции. Бактериальные системы абортивной инфекции очень разнообразны, но детали их функционирования пока изучены недостаточно.
К средствам противовирусной защиты бактерий относятся и системы рестрикции-модификации, в которые входят гены, кодирующие два белка-фермента – рестриктазу и метилазу. Рестриктаза узнает определенные последовательности ДНК длиной 4—6 нуклеотидов и вносит в них двуцепочечные разрывы. Метилаза, напротив, ковалентно модифицирует эти последовательности, добавляя к отдельным нуклеотидным основаниям метильные группы, что предотвращает их узнавание рестриктазой.
В ДНК бактерии, содержащей такую систему, все сайты модифицированы. И если бактерия заражается вирусом, ДНК которого не содержит подобной модификации, рестриктаза защитит от инфекции, разрушив вирусную ДНК. Многие вирусы «борются» с системами рестрикции-модификации, не используя в своих геномах последовательности, узнаваемые рестриктазой, – очевидно, что вирусные варианты с другой стратегией просто не оставили потомства.
Последней и в настоящее время самой интересной системой бактериального иммунитета является система CRISPR-Cas, с помощью которой бактерии способны «записывать» в собственный геном и передавать потомству информацию о фагах, с которыми они сталкивались в течение жизни. Наличие таких «воспоминаний» позволяет распознавать ДНК фага и эффективней противостоять ему при повторных инфекциях. В настоящее время к системам CRISPR-Cas приковано пристальное внимание, так как они стали основой революционной технологии редактирования геномов, которая в будущем, возможно, позволит лечить генетические заболевания и создавать новые породы и сорта сельскохозяйственных животных и растений.
Врага нужно знать в лицо
Системы CRISPR-Cas являются уникальным примером адаптивного иммунитета бактерий. При проникновении в клетку ДНК фага специальные белки Cas встраивают фрагменты вирусной ДНК длиной 25—40 нуклеотидов в определенный участок генома бактерии (Barrangou et al., 2007). Такие фрагменты называются спейсерами (от англ. spacer – промежуток), участок, где происходит встраивание, – CRISPR-кассета (от англ. Clustered Regularly Interspaced Short Palindromic Repeats), а сам процесс приобретения спейсеров – адаптацией.
Чтобы использовать спейсеры в борьбе с фаговой инфекцией, в клетке должен происходить еще один процесс, управляемый белками Cas, названный интерференцией. Суть его в том, что в ходе транскрипции CRISPR-кассеты образуется длинная молекула РНК, которая разрезается белками Cas на короткие фрагменты – защитные криспрРНК (крРНК), каждая из которых содержит один спейсер. Белки Cas вместе с молекулой крРНК образуют эффекторный комплекс, который сканирует всю ДНК клетки на наличие последовательностей, идентичных спейсеру (протоспейсеров). Найденные протоспейсеры расщепляются белками Cas (Westra et al., 2012; Jinek et al., 2012).
Системы CRISPR-Cas обнаружены у большинства прокариот – бактерий и архей. Хотя общий принцип действия всех известных систем CRISPR-Cas одинаков, механизмы их работы могут существенно отличаться в деталях. Наибольшие различия проявляются в строении и функционировании эффекторного комплекса, в связи с чем системы CRISPR-Cas делят на несколько типов. На сегодняшний день описаны шесть типов таких неродственных друг другу систем (Makarova et al., 2015; Shmakov et al., 2015).
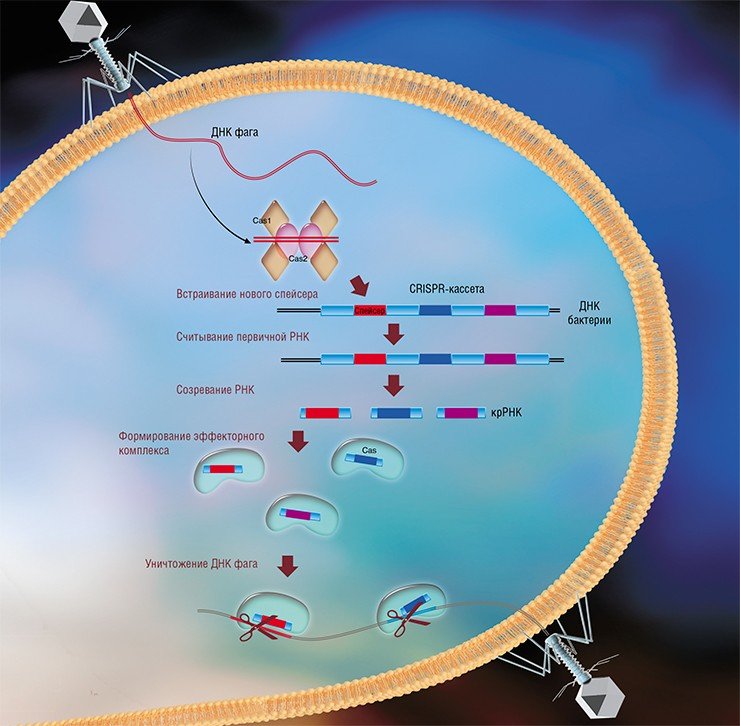
Наиболее изученной является система CRISPR-Cas I типа, которой обладает излюбленный объект молекулярно-биологических исследований – бактерия кишечная палочка (Esсherichia coli). Эффекторный комплекс в этой системе состоит из нескольких небольших белков Cas, каждый из которых отвечает за разные функции: разрезание длинной некодирующей CRISPR РНК, связывание коротких крРНК, поиск, а затем разрезание ДНК-мишени.
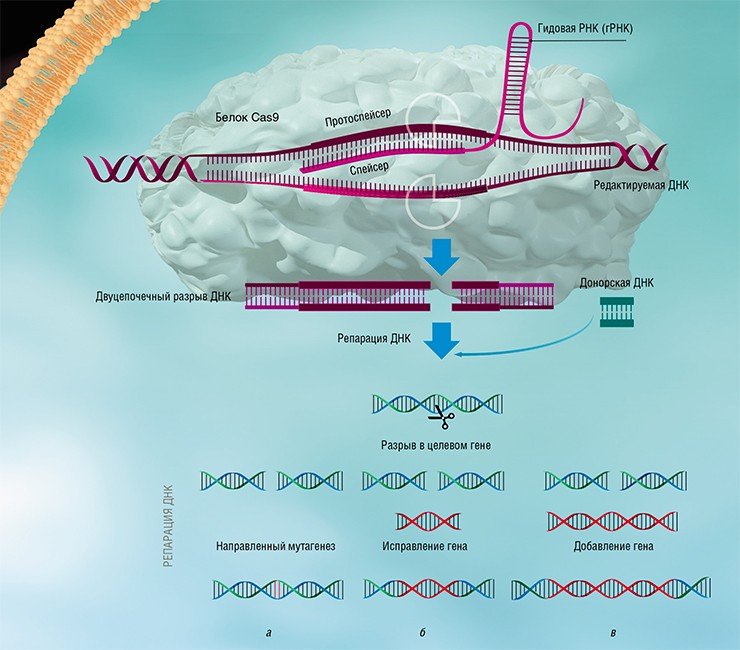
В системах II типа эффекторный комплекс образован единственным большим белком Cas9, который в одиночку справляется со всеми задачами. Именно простота и относительная компактность таких систем послужили основой для разработки технологии редактирования ДНК. Согласно этому методу, в клетки эукариот (например, человека) доставляют бактериальный белок Сas9 и крРНК, которую называют гидовой (гРНК). Вместо спейсера вирусного происхождения такая гРНК содержит целевую последовательность, соответствующую интересному для исследователя участку генома, например, где есть мутация, вызывающая какую-то болезнь. Получить же гРНК «на любой вкус» совсем несложно.
Эффекторный комплекс Cas9-гРНК вносит двуцепочечный разрыв в последовательность ДНК, точно соответствующую «гидовой» РНК. Если вместе с Cas9 и гРНК внести в клетку и последовательность ДНК, не содержащую мутацию, то место разрыва будет восстановлено по матрице «правильной» копии! Таким образом, используя разные гРНК, можно исправлять нежелательные мутации или вводить направленные изменения в гены-мишени. Высокая точность программируемого узнавания мишеней комплексом Cas9-гРНК и простота метода привели к лавинообразному росту работ по редактированию геномов клеток животных и растений (Jiang & Marraffini, 2015).
Гонка вооружений
В ходе эволюции бактерии и бактериофаги выработали ряд приспособлений, которые должны обеспечить каждому из участников «гонки вооружений» преимущество в борьбе с противником или возможность уклониться от его атаки.
Бактериофаги, как факторы среды, вызывают направленные изменения в геноме бактерий, которые наследуются и дают бактериям явное преимущество, спасая от повторных инфекций. Поэтому системы CRISPR-Cas можно считать примером ламарковской эволюции, при которой происходит наследование благоприобретенных признаков (Koonin et al., 2009)
Что касается систем CRISPR-Cas, то если фаг обзаведется мутацией в протоспейсере, эффективность его узнавания эффекторным комплексом снижается, и фаг получает возможность заразить клетку. Но и бактерия не оставит без внимания такую попытку ускользнуть от CRISPR-Cas: в качестве ответной реакции она начинает с резко возросшей эффективностью приобретать новые дополнительные спейсеры из ДНК уже «знакомого» фага, пусть и мутировавшего. Такое явление, названное праймированной адаптацией, многократно повышает эффективность защитного действия систем CRISPR-Cas (Datsenko et al., 2012).
Некоторые бактериофаги реагируют на наличие в бактериальной клетке систем CRISPR-Cas выработкой особых анти CRISPR-белков, способных связываться с белками Cas и блокировать их функции (Bondy-Denomy et al., 2015). Еще одно ухищрение — обмен участков генома вируса, на которые нацелена система CRISPR-Cas, на участки геномов родственных вирусов, отличающихся по составу нуклеотидной последовательности (Paez-Espino et al., 2015).
Результаты работ нашей лаборатории свидетельствуют, что зараженные клетки на самом деле погибают даже при наличии защиты CRISPR-Cas, но при этом они ограничивают численность вирусного потомства. Поэтому CRISPR-Cas правильнее относить к системам абортивной инфекции, а не к «настоящим» иммунным системам.
Благодаря постоянному совершенствованию биоинформатических алгоритмов поиска, а также включению в анализ все большего количества прокариотических геномов, открытие новых типов CRISPR-Cas систем является делом недалекого будущего. Предстоит также выяснить и детальные механизмы работы многих недавно открытых систем. Так, в статье, опубликованной в 2016 г. в журнале Science и посвященной анализу системы CRISPR-Cas VI типа, описан белок С2с2, образующий эффекторный комплекс с крРНК, который нацелен на деградацию не ДНК, а РНК (Abudayyeh et al., 2016). В будущем такое необычное свойство может быть использовано в медицине для регулирования активности генов путем изменения количества кодируемых ими РНК.
Изучение стратегий борьбы бактерий с бактериофагами, несмотря на свою кажущуюся фундаментальность и отвлеченность от задач практической медицины, принесло неоценимую пользу человечеству. Примерами этого могут служить методы молекулярного клонирования и редактирования геномов – направленного внесения или удаления мутаций и изменения уровня транскрипции определенных генов.
Благодаря быстрому развитию методов молекулярной биологии всего лишь через несколько лет после открытия механизма действия систем CRISPR-Cas была создана работающая технология геномного редактирования, способная бороться с болезнями, ранее считавшимися неизлечимыми. Доступность и простота этой технологии позволяют рассматривать ее как основу для медицины, ветеринарии, сельского хозяйства и биотехнологий будущего, которые будут базироваться на направленных и безопасных генных модификациях.
Нет никаких сомнений, что дальнейшее изучение взаимодействия бактерий и их вирусов может открыть перед нами такие возможности, о которых мы сейчас даже не подозреваем.
Литература
Abudayyeh O. O., Gootenberg J. S., Konermann S. et al. C 2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector // Science. 2016. V. 353: aaf5573.
Barrangou R., Fremaux C., Deveau H. et al. CRISPR provides acquired resistance against viruses in prokaryotes // Science. 2007. V. 315. P. 1709–1712.
Bikard D., Marraffini L. A. Innate and adaptive immunity in bacteria: mechanisms of programmed genetic variation to fight bacteriophages // Curr. Opin. Immunol. 2012. V. 1 P. 15–20.
Bondy-Denomy J., Garcia B., Strum S. et al. Multiple mechanisms for CRISPR-Cas inhibition by anti-CRISPR proteins // Nature. 2015. V. 526. P. 136–139.
Calendar R., Abedon S. T. The Bacteriophages // 2nd Ed., Oxford University Press. 2006.
Datsenko K. A., Pougach K., Tikhonov A. et al. Molecular memory of prior infections activates the CRISPR/Cas adaptive bacterial immunity system // Nat. Commun. 2012. V. 3. P. 945
Jiang W., Marraffini L. A. CRISPR-Cas: New Tools for Genetic Manipulations from Bacterial Immunity Systems // Annu. Rev. Microbiol. 2015. V. 69. P. 209–28.
Jinek M., Chylinski K., Fonfara I., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity // Science. 2012. V. 337. P. 816–821.
Koonin E. V., Wolf Y. I. Is evolution Darwinian or/and Lamarckian? // Biol. Direct. 2009. V. 4. P. 42.
Lopez-Pascua L., Buckling A. Increasing productivity accelerates host-parasite coevolution // J. Evol. Biol. 2008. V. 3. P. 853–860.
Makarova K. S., Wolf Y. I., et al. An updated evolutionary classification of CRISPR-Cas systems // Nat. Rev. Microbiol. 2015. V. 11. P. 722–736.
Moineau, S., Pandian S., Klaenhammer T. R. Restriction/modification systems and restriction endonucleases are more effective on lactococcal bacteriophages that have emerged recently in the dairy industry // Appl. Envir. Microbiol. 1993. V. 59. P. 197–202.
Neve H., Kemper U., et al. Monitoring and characterization of lactococcal bacteriophage in a dairy plant // Kiel. Milckwirtsch. Forschungsber. 1994. V. 46. P. 167–178.
Nuñez J. K., Harrington L. B., et al. Foreign DNA capture during CRISPR-Cas adaptive immunity // Nature. 2015a. V. 527. P. 535–538.
Nuñez J. K., Kranzusch P. J., et al. Cas1-Cas2 complex formation mediates spacer acquisition during CRISPR-Cas adaptive immunity // Nat. Struct. Mol. Biol. 2014. V. 21. P. 528–534.
Nuñez J. K., Lee A. S., Engelman A., Doudna J. A. Integrase-mediated spacer acquisition during CRISPR-Cas adaptive immunity // Nature. 2015b. V. 519. P. 193–198.
Paez-Espino D., Sharon I., et al. CRISPR Immunity Drives Rapid Phage Genome Evolution in Streptococcus thermophilus // MBio. 2015. V. 6: e00262–15.
Shmakov S., Abudayyeh O. O., Makarova K. S., et al. Discovery and Functional Characterization of Diverse Class 2 CRISPR-Cas Systems. // Mol. Cell. 2015. V. 60. P. 385–397
Tan D., Svenningsen S. L., Middelboe M. Quorum sensing determines the choice of antiphage defense strategy in Vibrio anguillarum. // mBio 2015. V. 6: e00627–15.
Westra E. R., van Erp P. B., Künne T., et al. CRISPR immunity relies on the consecutive binding and degradation of negatively supercoiled invader DNA by Cascade and Cas3 // Mol. Cell. 2012. V. 46. P. 595–605.
Работа поддержана грантом РФФИ (№ 16-34-01176)