Дисбактериоз влагалища: причины, профилактика и лечение
Дисбиоз (дисбактериоз) влагалища — это нарушение нормальной микрофлоры влагалища. Этим заболеванием в той или иной степени страдает большая часть женщин.
При нарушении микрофлоры изменяется равновесие между бактериями-нормальными обитателями влагалища. При этом снижается количество лакто- и бифидобактерий и увеличивается количество какого-то другого возбудителя. Этим другим возбудителем может быть одна из ключевых клеток (тогда развиваются гарднереллез, кандидоз и т.д.), может быть одна из половых инфекций (трихомониаз, хламидиоз), или же может быть любой сапрофитный возбудитель (кишечная палочка, протей, стрептококки, стафилококки и т.д.).
Дисбиоз влагалища и половые инфекции
Половые инфекции всегда связаны с нарушением микрофлоры влагалища. С одной стороны, нормальная микрофлора не допустит развития половой инфекции у женщины, и если обнаруживается половая инфекция, микрофлора не может быть не нарушена./514412219-56a7714b3df78cf77295fc54.jpg)
Ситуация, при которой во влагалище у женщины обитает только один лишь возбудитель ЗППП, почти никогда не возникает. Половая инфекция, одна или несколько, всегда находятся в ассоциации с условно-патогенной микрофлорой. И это всегда должно учитываться при лечении ЗППП. Иначе может возникнуть ситуация, при которой антибиотиками полностью убивается возбудитель ЗППП, а количество условно-патогенной инфекции лишь возрастает.
Лечение ЗППП
у женщин обязательно должно завершаться восстановлением микрофлоры влагалища. Если речь идет о серьезных инфекциях (хламидия, трихомонада) или нескольких ЗППП, то сначала есть смысл провести антибактериальную терапию против них, а затем заняться восстановлением микрофлоры влагалища следующим курсом. В менее сложных ситуациях есть смысл проводить сначала комплексную диагностику всей урогенитальной микрофлоры, а затем ее восстановление с одновременным устранением половой инфекции.
В менее сложных ситуациях есть смысл проводить сначала комплексную диагностику всей урогенитальной микрофлоры, а затем ее восстановление с одновременным устранением половой инфекции.
Дисбиоз влагалища и заболевания кишечника
Многие заболевания желудочно-кишечного тракта ведут к нарушению нормальной микрофлоры кишечника и развитию дисбактериоза. При дисбактериозе кишечника происходит примерно тоже самое, что и при дисбактериозе влагалища — в кишечнике живет большое количество какой-нибудь бактерии.
Стенка прямой кишки плотно соприкасается со стенкой влагалища, бактерии легко проходят через нее. При выраженном дисбактериозе кишечника нарушение вагинальной микрофлоры всегда обусловлено именно этим, и как правило из влагалища высевается одна из кишечных инфекций — кишечная палочка, энтерококки и др.
Лечение дисбиоза влагалища
в такой ситуации крайне затруднено, вероятность рецидива заболевания очень высока. Восстановление нормальной микрофлоры влагалища в такой ситуации возможно лишь при одновременном лечении заболеваний кишечника.
Восстановление нормальной микрофлоры влагалища в такой ситуации возможно лишь при одновременном лечении заболеваний кишечника.
Дисбиоз влагалища и половой партнер
Чаще всего нарушение микрофлоры влагалища у женщины не вызывает никаких проблем у ее полового партнера, даже при регулярной половой жизни без использования средств контрацепции. В отдельных случаях, когда имеет место выраженный дисбиоз влагалища, у мужчины могут развиваться явления баланопостита и неспецифического уретрита. Но это обычно бывает только в том случае, если у мужчины уже была предрасположенность к этим заболеваниям, в полностью здоровом организме они не разовьются.
Никакое заболевание полового партнера, за исключением венерических заболеваний, не оказывает влияния на микрофлору влагалища у женщины. Лечение дисбиоза влагалища у женщин не предполагает обязательного лечения полового партнера, если только хотя бы у одного из них не выявляется присутствие половой инфекции.
Дисбиоз влагалища и беременность
Беременность является одним из факторов, которые могут провоцировать обострение вагинального дисбиоза. На фоне беременности могут появляться или усиливаться выделения, зуд или жжение в половых органах, боль при половом акте и т.д. Это связано с тем, что во время беременности организм женщины подвергается серьезной гормональной перестройке, что не может не сказаться как на состоянии иммунитета, так и на вагинальной микрофлоре.
Спасибо за обращение.
Ваша заявка принята. Наш специалист свяжется с Вами в ближайшее время
Полноценное лечение дисбиоза влагалища во время беременности возможным не представляется. Даже если это лечение не связано с приемом антибиотиков, что крайне нежелательно во время беременности, оно всегда связано с иммунокоррекцией, а это во время беременности совершенно недопустимо. Поэтому задачей доктора при обострении дисбиоза влагалища у беременной женщины является лишь устранение симптомов и подготовка женщины к родам.
В нашей клинике с этой целью проводится курс процедур, которые если не нормализуют ситуацию, то делают ее более терпимой. Местное лечение, проводимое при этом, совершенно безвредно для плода. Если есть необходимость, это лечение на протяжении беременности можно проводить неоднократно.
Дисбиоз влагалища у девушек
Нарушение микрофлоры влагалища встречается у девушек, не начинавших половую жизнь, примерно с такой же частотой, как и у живущих активной половой жизнью женщин. Это связано несколько с другими факторами — нестабильность гормонального фона, становление цикла, а также с анатомическими особенностями строения девственной плевы.
Дисбиоз влагалища у девушек редко проявляется обильными выделениями, поскольку отверстия девственной плевы как правило не позволяют им выводиться из влагалища в том количестве, в каком они образуются. Поэтому развивается застой выделений во влагалище, и вероятность развития воспалительных заболеваний у девственниц выше.
Лечение дисбиоза влагалища у девушек-девственниц несколько затруднительно из-за того, что строение девственной плевы не всегда позволяет проводить обработки влагалища лекарствами должным образом. В отдельных случаях даже приходится прибегать к искусственному нарушению целостности девственной плевы — гименэктомии.
В «СМ-Клиника» врачи-гинекологи после проведения обследования и анализов выявят точные причины дисбактериоза влагалища и назначат эффективное комплексное лечение, которое приведет к восстановлению нормальной микрофлоры влагалища.
Дисбактериоз у будущей мамы: норма или патология?
Дисбактериоз кишечника – это нарушение качественного и количественного состава кишечной микрофлоры, впоследствии которого нарушается усвоение питательных веществ и расстраивается работа всей пищеварительной системы. Микрофлора кишечника выполняет сразу несколько функций: усвоение витаминов и микроэлементов, защита от болезнетворных бактерий и нейтрализация некоторых токсинов, поступающих с пищей. При нарушении состава микрофлоры эти процессы нарушаются.
Микрофлора кишечника выполняет сразу несколько функций: усвоение витаминов и микроэлементов, защита от болезнетворных бактерий и нейтрализация некоторых токсинов, поступающих с пищей. При нарушении состава микрофлоры эти процессы нарушаются.
Дисбактериоз при беременности – довольно частое явление из-за естественного снижения иммунитета будущей мамы: это необходимо для сохранения беременности и успешного развития малыша. Подавление защитных сил организма часто приводит к уменьшению состава полезных бактерий, что создает условия для развития патогенной микрофлоры.
Развитию дисбактериоза также способствуют хронические заболевания ЖКТ, прием антибиотиков, нехватка витаминов и несбалансированное питание. При ослабленном иммунитете опасность всех факторов риска значительно возрастает, поэтому будущей маме следует относиться к себе особенно внимательно!
Во время беременности дисбаланс микрофлоры проявляется таким образом:
- тяжесть в желудке после еды;
- хроническая диарея;
- изжога;
- вздутие живота;
- боль в области пупка;
- сухость кожи, аллергические высыпания;
- бессонница, упадок сил;
- на ранних сроках – тяжелый токсикоз.

Чем может грозить дисбактериоз?
Некоторые считают дисбактериоз нормальным явлением во время беременности. Действительно, будущие мамы часто сталкиваются с этой проблемой из-за естественного ослабления защитных сил организма. Однако это не означает, что с дисбактериозом не надо бороться. Активация условно-патогенных и болезнетворных бактерий способствует их проникновению в кровь и развитию инфекционных болезней.
Конечно, далеко не каждый случай дисбактериоза грозит заражением, однако серьезное нарушение состава кишечной микрофлоры может быть опасным. На ранних сроках запущенный дисбактериоз грозит выкидышем, на более поздних может стать причиной инфицирования плода и нарушения его развития. Для роженицы, в свою очередь, могут быть опасными инфекционные осложнения в послеродовом периоде. Поэтому запускать дисбактериоз не стоит! Если ваше самочувствие оставляет желать лучшего, пора принимать меры. Будущей маме необходимо знать, как лечить дисбактериоз, чтобы беременность и роды прошли без осложнений.
Поскольку целью терапии дисбактериоза является восстановление микрофлоры кишечника, в первую очередь назначаются пробиотики. Лучшим препаратом для будущих мам, а также для малышей с первых дней жизни признан пробиотик Лактомун. Особенно показан прием Лактомун при необходимости принимать антибиотики.
Лактомун содержит селективные штаммы лактобактерий и бифидобактерий, необходимых для нормального функционирования кишечника. Прием данного пробиотика способствует быстрому восстановлению кишечной микрофлоры. Вы забудете о неприятных симптомах: вынашивать малыша станет легко и приятно!
Дисбактериоз кишечника у женщин на ранних сроках беременности Текст научной статьи по специальности «Клиническая медицина»
УДК 618.2:616.34-07 https://doi.org/10.17816/JOWD68511-18
ДИСБАКТЕРИОЗ КИШЕЧНИКА У ЖЕНЩИН НА РАННИХ СРОКАХ БЕРЕМЕННОСТИ
© А. А. Безменко, А.А. Шмидт, Н.Д. Садовая
А. Безменко, А.А. Шмидт, Н.Д. Садовая
ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» Минобороны России, Санкт-Петербург
Для цитирования: Безменко А.А., Шмидт А.А., Садовая Н.Д. Дисбактериоз кишечника у женщин на ранних сроках беременности // Журнал акушерства и женских болезней. — 2019. — Т. 68. — № 5. — С. 11-18. https://doi.org/10.17816/JOWD68511-18
Поступила: 24.07.2019 Одобрена: 05.09.2019 Принята: 07.10.2019
■ Актуальность. В научных изданиях появились публикации о возможной роли системной эндотоксинемии, возникающей в результате дисбактериоза кишечника, в патогенезе невынашивания беременности.
Цель — провести сравнительную оценку состояния микробиоценоза кишечника и уровня эндотоксинемии у женщин с угрозой прерывания беременности и с физиологически протекающей беременностью.
Материалы и методы исследования. В исследовании приняли участие 50 женщин в возрасте от 18 до 35 лет (средний возраст — 28,1 ± 0,6 года) в сроке беременности от 6 до 18 нед. Основную группу составили 30 женщин с угрозой прерывания беременности. В контрольную группу вошли 20 женщин с нормально протекающей беременностью. Женщины основной и контрольной групп были обследованы в соответствии с требованиями приказа МЗ РФ № 572н. Дополнительно проводили качественный и количественный микробиологический анализ кала с помощью метода полимеразной цепной реакции в режиме реального времени. С целью оценки возможного системного влияния дисбактериоза кишечника на организм беременной был исследован уровень эндотоксинемии.
Результаты исследования. У 23,3 % пациенток основной группы был диагностирован дисбактериоз кишечника I степени, у 60 % — II степени, у 16,6 % — III степени. У пациенток контрольной группы дисбиотиче-ские изменения соответствовали преимущественно I (75 %) степени дисбактериоза, II степень была выявлена у 25 % пациенток, III степень зафиксирована не была. Микробиологические нарушения в основной группе заключались в снижении числа представителей нормофлоры кишечника при достоверно высокой концентрации условно-патогенных микроорганизмов. У пациенток контрольной группы преимущественно выявлено снижение интенсивности колонизации толстой кишки лактобактериями и бифидобактериями. Средний уровень эндоток-синемии у пациенток основной группы составил 0,52 ± 0,05 нмоль/мл и классифицирован как «повышенный», достоверно превышая таковой у пациентов контрольной группы (0,34 ± 0,05 нмоль/мл).
Микробиологические нарушения в основной группе заключались в снижении числа представителей нормофлоры кишечника при достоверно высокой концентрации условно-патогенных микроорганизмов. У пациенток контрольной группы преимущественно выявлено снижение интенсивности колонизации толстой кишки лактобактериями и бифидобактериями. Средний уровень эндоток-синемии у пациенток основной группы составил 0,52 ± 0,05 нмоль/мл и классифицирован как «повышенный», достоверно превышая таковой у пациентов контрольной группы (0,34 ± 0,05 нмоль/мл).
Выводы. Микробиологические нарушения в составе кишечного биоценоза у пациенток с угрозой прерывания беременности были обусловлены достоверным снижением количества нормофлоры на фоне увеличенного содержания условно-патогенных микроорганизмов с высоким патогенным потенциалом и их ассоциаций. Микрофлора кишечника при нормально протекающей беременности характеризовалась преимущественно снижением интенсивности колонизации толстой кишки лакто- и бифидобактериями. Уровень эндотоксинемии имел прямую пропорциональную зависимость от степени дисбактериоза кишечника и был достоверно выше у женщин основной группы.
Уровень эндотоксинемии имел прямую пропорциональную зависимость от степени дисбактериоза кишечника и был достоверно выше у женщин основной группы.
■ Ключевые слова: невынашивание беременности; дисбактериоз кишечника; эндотоксин; эндотоксин-индуци-рованный аборт.
INTESTINAL DYSBIOSIS IN WOMEN IN EARLY PREGNANCY
© A.A. Bezmenko, A.A. Schmidt, N.D. Sadovaya
Military Medical Academy named after S.M. Kirov, Saint Petersburg, Russia
For citation: Bezmenko AA, Schmidt AA, Sadovaya ND. Intestinal dysbiosis in women in early pregnancy. Journal of Obstetrics and Women’s Diseases. 2019;68(5):11-18. https://doi.org/10.17816/JOWD68511-18
Received: July 24, 2019 Revised: September 05, 2019 Accepted: October 7, 2019
■ Hypothesis/aims of study. To date, there have been some publications on the possible role of systemic endotoxinemia resulting from intestinal dysbiosis in the pathogenesis of miscarriage. The aim of this study was to compare the state of intestinal microbiocenosis and the level of endotoxinemia in women with threatened abortion and normal pregnancy.
To date, there have been some publications on the possible role of systemic endotoxinemia resulting from intestinal dysbiosis in the pathogenesis of miscarriage. The aim of this study was to compare the state of intestinal microbiocenosis and the level of endotoxinemia in women with threatened abortion and normal pregnancy.
Журнал акушерства и женских болезней 2019 Том со Выпуск г ISSN 1684-0461 (Print)
Journal of Obstetrics and Women’s Diseases 2019 Volume 68 Issue 5 ISSN 1683-9366 (Online)
Study design, materials and methods. The study involved 50 women aged 18 to 35 years (mean age 28.1 ± 0.6 years) in pregnancy from 6 to 18 weeks. The main group consisted of 30 women with threatened abortion. The control group included 20 women with normal pregnancy. Patients of the main and control groups were examined in accordance with the order of the Ministry of Health of the Russian Federation No. 572n. In addition, a qualitative and quantitative microbiological analysis of feces was performed using the real-time PCR method. The level of endotoxinemia was studied to assess the possible systemic effect of intestinal dysbacteriosis on a pregnant woman.
572n. In addition, a qualitative and quantitative microbiological analysis of feces was performed using the real-time PCR method. The level of endotoxinemia was studied to assess the possible systemic effect of intestinal dysbacteriosis on a pregnant woman.
Results. 23.3% of patients of the main group were diagnosed with intestinal dysbiosis of degree I, 60% of degree II, and 16.6% of degree III. In patients of the control group, dysbiotic changes corresponded mainly to degree I (75%) and degree II (25%). Degree III was not detected. Microbiological disorders in the main group were characterized by a decrease in the number of members of intestinal normal flora and a high concentration of opportunistic microorganisms. Microbiological disorders in the control group were characterized by a decrease in the intensity of colonization of the large intestine by lactobacilli and bifidobacteria. The average level of endotoxinemia in patients of the main group was 0. 52 ± 0.05 nmol/ml and was classified as «elevated», significantly exceeding that in patients of the control group — 0.34 ± 0.05 nmol/ml.
52 ± 0.05 nmol/ml and was classified as «elevated», significantly exceeding that in patients of the control group — 0.34 ± 0.05 nmol/ml.
Conclusion. In patients with threatened abortion, intestinal microflora was characterized by a decrease in normal flora and a high concentration of opportunistic microorganisms with high a pathogenic potential and their associations. During normal pregnancy, microbiological disorders in the intestinal biocenosis were characterized by a decrease in the intensity of colonization of the large intestine by lactobacilli and bifidobacteria. The level of endotoxemia was directly proportional to the degree of dysbacteriosis of the intestine and was significantly higher in women of the main group.
■ Keywords: miscarriage; intestinal dysbiosis; endotoxin; endotoxin-induced abortion.
Введение
В настоящее время дисбактериоз кишечника широко обсуждается в литературе, однако остается ряд спорных вопросов о его клинической значимости [1-4].
Установлено, что во время беременности кишечная микробиота претерпевает ряд структурных и функциональных изменений, обусловленных перестройкой эндокринной и иммунной систем, а также некоторыми анатомическими особенностями, вызванными увеличением объема матки. Как следствие, замедляется перистальтика кишечника, снижается тонус гладкой мускулатуры кишечной стенки, желчного пузыря и желчевыводящих путей, что увеличивает длительность экспозиции кишечного содержимого в терминальных отделах толстой кишки [5-6]. Длительный толстокишечный стаз приводит к активации условно-патогенной микрофлоры (УПМ), что не только ухудшает качество жизни пациенток, но и может создать угрозу для нормального течения беременности [7].
С.И. Жук и A.A. Шляхтина (2018) провели микробиологический и бактериологический скрининг фекальной микрофлоры беременных и установили, что основная часть обследованных имела различные дисбиотические нарушения, которые осложняли течение беременности [8].
В ряде работ отечественных и зарубежных авторов показано, что индуцированная кишечной микробиотой «метаболическая эндоток-семия» в период беременности через цепочку
последовательных патобиохимических реакций может привести к невынашиванию, формированию ожирения, гестационного сахарного диабета, гестационной артериальной гипертензии (в том числе преэклампсии), преждевременным родам, задержке роста плода [9-14].
Эндотоксин (или липополисахарид) — это главный компонент наружной мембраны грамотрицательных бактерий, определяющий сложный иммунный и воспалительный ответ в организме. Основным источником эндотоксина в крови в норме является микрофлора кишечника; это подтверждают относительно низкие его концентрации у новорожденных, желудочно-кишечный тракт которых в первые часы жизни минимально колонизирован грам-отрицательными бактериями [15, 16].
При физиологических условиях эндотоксин проникает в кровоток в незначительных количествах, что обеспечивает адаптацию макроорганизма к изменяющимся условиям жизнедеятельности [17-19]. При дисбактериозе кишечника липополисахариды поступают в системный кровоток в избыточном количестве на фоне абсолютной или относительной недостаточности эндотоксин-связывающих систем, что влечет за собой развитие токсиновой агрессии, которая может быть непосредственной причиной самых разнообразных синдромов и заболеваний.
В экспериментах на животных показано, что введение антигена кишечной палочки (эндотоксина) приводило к повышению уровня простагландинов, тромбоксана В2, кортизо-
Том Volume
ла и снижению прогестерона в плазме крови и, как следствие, к прерыванию беременности. Тяжесть клинических проявлений зависела от дозы эндотоксина и не зависела от срока беременности, но абортивный эффект наблюдался чаще на ранних сроках [14, 20, 21].
Несмотря на очевидную значимость кишечной микробиоты, играющей роль «биохимической лаборатории» в поддержании ге-стационного процесса, число исследований, посвященных данной проблеме, крайне невелико, поэтому изучение данного вопроса является не просто актуальным научным направлением, а может быть одним из способов предупреждения ранних репродуктивных потерь.
Цель — сравнить состояние микробиоценоза кишечника и уровня эндотоксинемии у пациенток с угрозой прерывания беременности и у пациенток с физиологически протекающей беременностью.
Методы
Всего в исследовании приняли участие 50 женщин в возрасте от 18 до 35 лет (средний возраст — 28,1 ± 0,6 года) в сроке беременности от 6 до 18 нед. Основную группу составили 30 женщин, госпитализированных в гинекологическое отделение клиники акушерства и гинекологии Военно-медицинской академии им. С.М. Кирова с угрозой прерывания беременности. В контрольную группу вошли женщины (п = 20) с физиологически протекающей беременностью, состоявшие на учете по беременности в женской консультации клиники акушерства и гинекологии.
С.М. Кирова с угрозой прерывания беременности. В контрольную группу вошли женщины (п = 20) с физиологически протекающей беременностью, состоявшие на учете по беременности в женской консультации клиники акушерства и гинекологии.
Критериями исключения при отборе пациенток являлись: беременность, наступившая в результате применения вспомогательных репродуктивных технологий; беременность, протекающая на фоне подтвержденных генетических, анатомических, эндокринных, иммунологических и тромбофилических факторов риска невынашивания; наличие у беременных инфекций, в том числе передаваемых половым путем; многоплодная беременность.
Пациентки основной и контрольной групп были обследованы в соответствии с требованиями приказа Министерства здравоохранения Российской Федерации № 572н. Дополнительно проводили качественный и количественный микробиологический анализ кала с помощью метода полимеразной цепной реакции (ПЦР) в режиме реального времени. В основе метода лежит комплементарное достраивание
В основе метода лежит комплементарное достраивание
участка геномной ДНК или РНК возбудителя, осуществляемое in vitro с помощью фермента термостабильной ДНК-полимеразы. Как показывают современные исследования, метод ПЦР с флуоресцентной детекцией результатов в режиме реального времени может быть с успехом применен для оценки микробиоценоза кишечника [22]. Материал из ампулы прямой кишки брали ложкой Фолькмана, введенной на глубину 4 см. Полученные клинические образцы помещали в пробирки типа «Эппендорф» с транспортной средой (стерильный изотонический водно-солевой буферный раствор с консервантом). Образцы биоматериалов хранили в морозильной камере при температуре -18 °С. В лабораторию образцы доставляли с учетом правил транспортировки. Лабораторный анализ выполняли на специализированных приборах ДТ96, ДТ322 (ООО «НПО ДНК-Технология», Россия) для проведения ПЦР с детекцией результата в графическом и цифровом форматах в режиме реального времени.
При оценке состояния биотопа кишечника выделяли четыре типа микробиоценозов [23]. При нормоценозе содержание лактобацилл составляло более 107 КОЕ/г, бифидобактерий — более 109 КОЕ/г, кишечной палочки — более 108 КОЕ/г, количество УПМ — не более 103 КОЕ/г. Дисбактериоз кишечника I степени характеризовался снижением содержания лак-тобацилл (менее 106 КОЕ/г) и бифидобактерий (менее 109 КОЕ/г), повышенным или пониженным содержанием кишечной палочки (более или менее 108 КОЕ/г), появлением УПМ в титре 103-104 КОЕ/г. Дисбактериоз кишечника II степени характеризовался снижением содержания лактобацилл (менее 106 КОЕ/г), бифидобактерий (108 КОЕ/г) и кишечной палочки (менее 108 КОЕ/г), появлением УПМ в количестве более 104 КОЕ/г. При дисбактериозе кишечника III степени отмечалось снижение содержания лактобацилл и бифидобактерий менее
105 КОЕ/г и 107 КОЕ/г соответственно, снижение содержания кишечной палочки с неизмененными ферментативными свойствами (менее
106 КОЕ/г), появление слабоферментирующей и/или гемолизирующей кишечной палочки (более 104 КОЕ/г), увеличение содержания лактозо-негативных энтеробактерий и кокковой флоры (более 106 КОЕ/г) (табл. 1).
1).
С целью оценки возможного системного влияния дисбактериоза кишечника на организм беременной определяли уровень эндотоксине-мии. Кровь исследовали с помощью метода га-
I
2019
Таблица 1 / Table 1
Показатели микробиологического исследования при различных типах биотопов кишечника Microbiological indicators in various types of intestinal biotopes
Микробиологические типы Нормальная флора (lg ГЭ/г) Условно-патогенные
биотопов кишечника лактобациллы бифидобактерии кишечная палочка (lg ГЭ/г)
Нормоценоз >7 >9 >8 <3
Дисбактериоз I степени <6 <9 > или <8 <4
Дисбактериоз II степени <6 <8 <8 >4
Дисбактериоз III степени <5 <7 <6, появление слабоферменти-рующей и/или гемолизирующей кишечной палочки (более 104 КОЕ/г) >6
зовой хроматографии — масс-спектрометрии, в основе которого лежит высокоточное определение присутствия молекулярных признаков микроорганизмов из числа их клеточных липидов. Для этого анализа у пациентов основной и контрольной групп кровь из вены в количестве не менее 5 мл отбирали в пробирку с гепарином и помещали в морозильную камеру при температуре -18 °С для хранения. После транспортировки образцов в лабораторию жидкие пробы высушивали с добавлением равного по объему количества метанола и подвергали кислому метанолизу в 3,65 % растворе соляной кислоты. Освобожденные жирные кислоты и альдегиды из сложных липидов микроорганизмов экстрагировали гексаном. далее исследование осуществляли в режиме полного сканирования с применением газового хроматографа Agilent Technologies 6890 (США), оснащенного масс-спектрометрическим детектором Agilent Technologies 5973 (США). Хроматографическое разделение компонентов происходило на кварцевой капиллярной колонке НР5 диаметром 0,2 мм, длиной 25 м и толщиной слоя 0,33 мкм. Газ-носитель — гелий, скорость потока — 24 мл/мин, скорость потока через колонку — 1,2 мл/мин. Состав анализировали в динамическом режиме на масс-спектрометре, полученные данные обрабатывали с помощью компьютерной программы автоматического анализа [24].
Для этого анализа у пациентов основной и контрольной групп кровь из вены в количестве не менее 5 мл отбирали в пробирку с гепарином и помещали в морозильную камеру при температуре -18 °С для хранения. После транспортировки образцов в лабораторию жидкие пробы высушивали с добавлением равного по объему количества метанола и подвергали кислому метанолизу в 3,65 % растворе соляной кислоты. Освобожденные жирные кислоты и альдегиды из сложных липидов микроорганизмов экстрагировали гексаном. далее исследование осуществляли в режиме полного сканирования с применением газового хроматографа Agilent Technologies 6890 (США), оснащенного масс-спектрометрическим детектором Agilent Technologies 5973 (США). Хроматографическое разделение компонентов происходило на кварцевой капиллярной колонке НР5 диаметром 0,2 мм, длиной 25 м и толщиной слоя 0,33 мкм. Газ-носитель — гелий, скорость потока — 24 мл/мин, скорость потока через колонку — 1,2 мл/мин. Состав анализировали в динамическом режиме на масс-спектрометре, полученные данные обрабатывали с помощью компьютерной программы автоматического анализа [24]. -критерия Спирмена. Различия считали статистически достоверными при определении вероятности 95 % (р < 0,05).
-критерия Спирмена. Различия считали статистически достоверными при определении вероятности 95 % (р < 0,05).
Результаты и обсуждения
Из 50 обследованных беременных нормо-ценоз кишечника не был выявлен ни в одном случае.
У 23,3 % (п = 7) пациенток основной группы был диагностирован дисбактериоз кишечника I степени, у 60 % (п = 18) пациенток — II степени, у 16,6 % (п = 5) пациенток — III степени. В то время как у пациенток контрольной группы были выявлены дисбиотические изменения, соответствующие преимущественно I (75 %, п = 15) и в меньшей мере II (25 %, п = 5) степеням дисбактериоза (см. рисунок).
М.Н. Гапон и др. (2016) установили, что дис-бактериоз кишечника присутствовал у всех беременных и лишь в 35 % случаев у небеременных [25].
Т. Н. Савченко и др. (2013) также анализировали микробиоценоз пищеварительного тракта у пациенток с невынашиванием беременности, в результате чего был выявлен дисбактериоз у 84 % беременных с клиникой начавшегося выкидыша (первая подгруппа), у 95,7 % с прервавшейся беременностью (вторая подгруппа) и у 55 % здоровых беременных (группа сравнения). Дисбактериоз кишечника III степени
Н. Савченко и др. (2013) также анализировали микробиоценоз пищеварительного тракта у пациенток с невынашиванием беременности, в результате чего был выявлен дисбактериоз у 84 % беременных с клиникой начавшегося выкидыша (первая подгруппа), у 95,7 % с прервавшейся беременностью (вторая подгруппа) и у 55 % здоровых беременных (группа сравнения). Дисбактериоз кишечника III степени
Том Volume
в первой и второй подгруппах выявляли достоверно чаще (р < 0,05), чем в группе сравнения (показатели составили 25,3; 34,1 и 5,0 % соответственно) [26].
В работе С. А. Карпеева (2015) был обследован микробиоценоз кишечника у беременных с привычным невынашиванием и только у 4,3 % из них обнаружен нормоценоз, а в 34,1 % случаев был выявлен дисбактериоз кишечника III степени [27].
При изучении качественного и количественного состава кишечной микрофлоры у пациенток основной группы установлено достоверное снижение числа представителей нор-мофлоры кишечника (Lactobacillus spp. , Bifidobacterium spp., Bacteroides spp.) по сравнению с контрольной группой (табл. 2), а также отмечена достоверно высокая концентрация условно-патогенных микроорганизмов: Fusobacteriaceae, Enterobacter sp., Clostridium cocc., Clostridium dif. и их многокомпонентная ассоциация.
, Bifidobacterium spp., Bacteroides spp.) по сравнению с контрольной группой (табл. 2), а также отмечена достоверно высокая концентрация условно-патогенных микроорганизмов: Fusobacteriaceae, Enterobacter sp., Clostridium cocc., Clostridium dif. и их многокомпонентная ассоциация.
Микробиологические нарушения в контрольной группе были обусловлены преимущественно снижением интенсивности колонизации толстой кишки лактобактериями и би-фидобактериями.
%
Основная группа Контрольная группа
Main group Control group
■ I степень ■ II степень ■ III степень I degree II degree III degree
Степень нарушения микрофлоры кишечника у пациентов основной и контрольной групп исследования The degree of intestinal microflora disturbance in patients of the main and control groups
По данным И.![]() С. Полищук и др. (2016), микробиоценоз у беременных характеризовался низким содержанием бифидобактерий и высокой численностью условно-патогенных микроорганизмов, среди которых чаще всего встречались бактерии родов Clostridium, Enterobacter, Klebsiella, Pseudomonas, Proteus, атипичные эше-рихии и энтерококки [28].
С. Полищук и др. (2016), микробиоценоз у беременных характеризовался низким содержанием бифидобактерий и высокой численностью условно-патогенных микроорганизмов, среди которых чаще всего встречались бактерии родов Clostridium, Enterobacter, Klebsiella, Pseudomonas, Proteus, атипичные эше-рихии и энтерококки [28].
Таблица 2 / Table 2
Результаты микробиологического исследования кала методом полимеразной цепной реакции в режиме
реального времени у пациенток основной и контрольной групп исследования
Results of microbiological fecal examination by real-time PCR in patients of the main and control groups
Представители кишечной микрофлоры Основная группа (среднее арифметическое, lg КОЕ/г) Контрольная группа (среднее арифметическое, lg КОЕ/г)
Lactobacillus spp. 3,0 4,16
3,0 4,16
Bifidobacterium spp. 2,9* 5,16
Bacteroides spp. 4,2* 6,43
Parabacteroides spp. 3,23* 5,76
Alistipes spp. 3,04* 5,36
Prevotella spp. 4,26* 6,56
Enterococcus spp. 1,76 3,36
Fusobacteriaceae 2,65* 0,92
Staphylococcus spp. 2,47 2,14
Enterobacter sp. 4,28* 2,92
Streptococcus spp. 3,46 3,56
Clostridium cocc. 5,01* 2,87
Clostridium dif. 4,56* 3,62
Примечание. * При р < 0,05.
* При р < 0,05.
Журнал акушерства и женских болезней jn* Q Том гп Выпуск г ISSN 1684-0461 (Print)
Journal of Obstetrics and Women’s Diseases 2019 Volume 68 Issue 5 ISSN 1683-9366 (Online)
С.Ф. Субханкулова и др. (2008) обнаружили достоверный дефицит нормальной микрофлоры у беременных, страдающих запорами [29].
В работе Carla R. Taddei et al. (2018) показано, что возникновение или обострение акушерских и/или системных заболеваний у беременных ассоциировано с низким микробным разнообразием, увеличением количества патогенных представителей типа Firmicutes и Proteobacteria Phyla и уменьшением эубиотических бактерий, таких как Bifidobacterium, Faecalibacterium и Akkermansia, в кишечной микробиоте [30].
Анализ результатов газовой хроматографии — масс-спектрометрии показал, что средний уровень эндотоксинемии у пациентов основной группы составил 0,52 ± 0,05 нмоль/мл и классифицировался как «повышенный», достоверно превышая таковой у пациентов контрольной группы (0,34 ± 0,05 нмоль/мл, р < 0,05), что согласуется с исследованием С. Ф. Субханкуловой, по результатам которого уровень эндотоксина в сыворотке крови у беременных, страдающих запорами, составлял 1,53 ± 0,23 ЭЕ/мл, достоверно превышая таковой у здоровых беременных — 0,65 ± 0,06 ЭЕ/мл [29].
Ф. Субханкуловой, по результатам которого уровень эндотоксина в сыворотке крови у беременных, страдающих запорами, составлял 1,53 ± 0,23 ЭЕ/мл, достоверно превышая таковой у здоровых беременных — 0,65 ± 0,06 ЭЕ/мл [29].
Выявлена также прямая корреляционная связь между степенью дисбактериоза кишечника и уровнем эндотоксинемии, что связано с более выраженными нарушениями в составе кишечного микробиоценоза за счет достоверно большего количества микроорганизмов с высоким патогенным потенциалом (условно-патогенных микроорганизмов).
Заключение
Таким образом, микробиологические нарушения в составе кишечного биоценоза у пациенток с угрозой прерывания беременности были связаны с достоверным снижением количества нормофлоры на фоне увеличенного содержания условно-патогенных микроорганизмов с высоким патогенным потенциалом и их ассоциаций. Микрофлора кишечника при физиологически протекающей беременности характеризовалась преимущественно снижением интенсивности колонизации толстой кишки лакто- и бифидобактериями.
Микрофлора кишечника при физиологически протекающей беременности характеризовалась преимущественно снижением интенсивности колонизации толстой кишки лакто- и бифидобактериями.
Уровень эндотоксинемии (или эндотоксина в крови) был достоверно выше у женщин основной группы и имел прямую пропорциональную зависимость от степени дисбактерио-за кишечника (0,52 ± 0,05 нмоль/мл) в сравнении с группой контроля (0,34 ± 0,05 нмоль/мл, р < 0,05).
Литература
1. Ардатская М.Д., Бельмер С.В., Добрица В.П., и др. Дис-биоз (дисбактериоз) кишечника: современное состояние проблемы, комплексная диагностика и лечебная коррекция // Экспериментальная и клиническая гастроэнтерология. — 2015. — Т. 117. — № 5. — С. 13-50. [Ardat-skaya MD, Bel’mer SV, Dobritsa VP, et al. Colon dysbacteriosis (dysbiosis): modern state of the problem, comprehensive diagnosis and treatment correction. Eksperimental’naya i klinicheskaya gastroenterologiya. 2015;117(5):13-50. (In Russ.)]
Eksperimental’naya i klinicheskaya gastroenterologiya. 2015;117(5):13-50. (In Russ.)]
2. Бронивец И.Н. Дисбактериоз кишечника: диагностика, профилактика и лечение // Медицинские новости. -2016. — № 11. — С. 56-58. [Bronovets IN. Dysbacteriosis of the intestine: diagnosis, prevention and treatment. Medi-tsinskiye novosti. 2016;(11):56-58. (In Russ.)]
3. Мусаев М.Р., Бекметова Ш.К., Матмуратова С.О., Махмудова М.М. Дисбиотические процессы в системе неспецифической резистентности у беременных с экстрагени-тальными заболеваниями // Вестник проблем биологии и медицины. — 2014. — № 1. — С. 153-157. [Musaev MR, Bekmetova ShK, Matmuratova SO, Makhmudov MM. Dis-biotic proccesses in pregnant women with extragenital diseases in nonspecific resistance system. Visnyk problem biologii i medycyny. 2014;(1):153-157. (In Russ.)]
4. Янковский Д. С., Дымент Г.С. Микрофлора и здоровье человека. — Киев: ТОВ «Червона Рута-Турс», 2008. -552 с. [Jankovskii DS, Dyment GS. Mikroflora i zdorov’e cheloveka. Kiev: TOV «Chervona Ruta-Turs»; 2008. 552 р. (In Russ.)]
С., Дымент Г.С. Микрофлора и здоровье человека. — Киев: ТОВ «Червона Рута-Турс», 2008. -552 с. [Jankovskii DS, Dyment GS. Mikroflora i zdorov’e cheloveka. Kiev: TOV «Chervona Ruta-Turs»; 2008. 552 р. (In Russ.)]
5. Вялов С.С., Бакулин И.Г., Хурасева А.Б., Яковлев А.А. Эффективность комплексных пробиотиков при запорах у беременных женщин // Архив внутренней медицины. — 2013. — № 1. — С. 14-18. [Vjalov SS, Bakulin IG, Huraseva AB, Jakovlev AA. Jeffektivnost’ kompleksnyh pro-biotikov pri zaporah u beremennyh zhenshhin. Arhiv vnu-trennei mediciny. 2013;(1):14-18. (In Russ.)]
6. Koren O, Goodrich JK, Cullender TC, et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy. Cell. 2012;150(3):470-480. https://doi. org/10.1016/j.cell.2012.07.008.
7. Соколова М.Ю. Экстрагенитальная патология у беременных: руководство для врачей. — М.: Медицинское информационное агентство, 2011. — 331 c. [Sokolo-va MYu. Jekstragenital’naia patologiia u beremennyh: ru-kovodstvo dlia vrachei. Moscow: Med. inform. agentstvo; 2011. 331 р. (In Russ.)]
— М.: Медицинское информационное агентство, 2011. — 331 c. [Sokolo-va MYu. Jekstragenital’naia patologiia u beremennyh: ru-kovodstvo dlia vrachei. Moscow: Med. inform. agentstvo; 2011. 331 р. (In Russ.)]
8. Жук С.И., Шляхтина А.А. Управление биотопами женщины — новые подходы // Здоровье женщины. — 2018. -№ 6. — С. 34-36. [Zhuk SI, Shlyakhtina AA. Managing biotopes of women — new approaches. Zdorov’ia zhinky. 2018;(6):34-36. (In Russ.)]
9. Бондаренко К.Р., Доброхотова Ю.Э., Новик М.Ю. Возможности профилактики поздних акушерских ослож-
I
2019
нений путем коррекции эндогенной микробиоты // 18. Медицинский алфавит. — 2017. — Т. 3. — № 23. -С. 6-14. [Bondarenko KR, Dobrokhotova YuE, Novik MYu. Approaches in prevention of late pregnancy complications by correction of endogenous microbiota.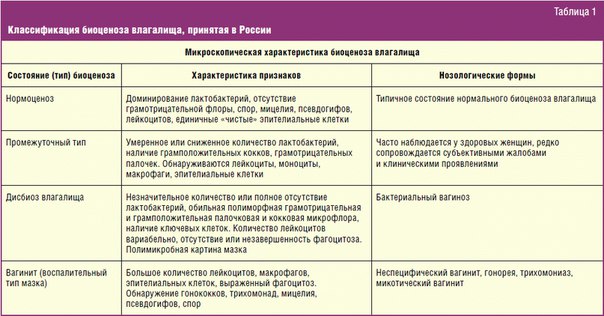 Medicinskii alfavit. 2017;3(23):6-14. (In Russ.)] 19.
Medicinskii alfavit. 2017;3(23):6-14. (In Russ.)] 19.
10. Гайсина Ю.Р., Ахмадуллина Ю.А., Гильманов А.Ж., Мавзютов А.Р. Эндотоксинемия и влияние микробных липополисахаридов на систему гемостаза у женщин
с бактериальным вагинозом // Медицинский вестник 20. Башкортостана. — 2011. — Т. 6. — № 3. — С. 155-159. [Gai-sina YuR, Akhmadullina YuA, Gilmanov AZh, Mavzyutov AR. Endotoxinemia and effects of microbial lipopolysaccharides on hemostasis in women with bacterial vaginosis. Bashkor- 21. tostan medical journal. 2011;6(3):155-159. (In Russ.)]
11. Mission JF, Marshall NE, Caughey AB. Pregnancy risks associated with obesity. Obstet Gynecol Clin North Am. 2015;42(2):335-353. https://doi.org/10.1016/jj.ogc.2015. 01.008. 22.
12. Wang X, Quinn PJ. Endotoxins: lipopolysaccharides of gramnegative bacteria. Subcell Biochem. 2010;53:3-25. https:// doi.org/10.1007/978-90-481-9078-2_1.
Subcell Biochem. 2010;53:3-25. https:// doi.org/10.1007/978-90-481-9078-2_1.
13. Zhang D, Huang Y, Ye D. Intestinal dysbiosis: an emerging cause of pregnancy complications? Med Hypotheses. 2015;84(3):223-226. https://doi.org/10.1016/j.mehy. 2014.12.029.
14. Giri SN, Emau P, Cullor JS, et al. Effects of endotoxin infu- 23. sion on circulating levels of eicosanoids, progesterone, cortisol, glucose and lactic acid, and abortion in pregnant cows. Vet Microbiol. 1990;21(3):211-231. https://doi. org/10.1016/0378-1135(90)90033-r.
15. Айламазян Э.К., Шипицына Е.В., Савичева А.М. Микро-биота женщины и исходы беременности // Журнал акушерства и женских болезней. — 2016. — Т. 65. — № 4. —
С. 6-14. [Aylamazyan EK, Shipitsyna EV, Savicheva AM. 24. Woman’s microbiota and pregnancy outcomes. Zhur-nal akusherstva i zhenskikh boleznei. 2016;65(4):6-14. (In Russ.)]. https://doi.org/10.17816/J0WD6546-14.
Zhur-nal akusherstva i zhenskikh boleznei. 2016;65(4):6-14. (In Russ.)]. https://doi.org/10.17816/J0WD6546-14.
16. Рыбина Е.В., Кенбаева К.Г., Савичева A.M. Особенности микрофлоры желудочно-кишечного тракта доношенных новорожденных при разных способах родоразреше-ния // Педиатр. — 2014. — Т. 5. — № 3. — С. 30-32. [Rybi-na YeV, Kenbayeva KG, Savicheva AM. Gastrointestinal microflora of full-term newborn infants with different modes 25. of delivery. Pediatrics. 2014;5(3):30-32. (In Russ.)]. https:// doi.org/10.17816/PED5330-32.
17. Бондаренко В.М., Лиходед В.Г., Яковлев М.Ю. Определение эндотоксина грамотрицательных бактерий в крови человека // Журнал микробиологии, эпидемиологии и иммунобиологии. — 2002. — № 2. — С. 83-89. [Bondarenko VM, Lihoded VG, Yakovlev MYu. Opredelenie 26. ehndotoksina gramotricatel’nyh bakterii v krovi cheloveka. Journal of microbiology, epidemiology and immunobiology. 2002;(2):83-89. (In Russ.)]
2002;(2):83-89. (In Russ.)]
Кира Е.Ф. Пробиотики в восстановлении микробиоценоза влагалища // Акушерство и гинекология. — 2017. — № 5. -С. 32-38. [Kira EF. Probiotics in the restoration of vaginal microbiocenosis. Akush Ginekol (Mosk). 2017;(5):32-38. (In Russ.)]. https://doi.org/10.18565/aig.2017.5.32-8. Yakovlev MYu. Elements of endotoxin theory of human physiology and pathology: systemic endotoxinemia, endo-toxin aggression and endotoxin insufficiency. J Endotoxin Res. 2000;6(2):120-131.
Wang YY, Tawfik 0, Wood GW. Endotoxin-induced abortion in mice is mediated by activated fetal macrophages. J Leukoc Biol. 1998;63(1):40-50. https://doi.org/10.1002/ jlb.63.1.40.
Toyama RP, Xikota JC, Schwarzbold ML, et al. Dose-dependent sickness behavior, abortion and inflammation induced by systemic LPS injection in pregnant mice. J Matern Fetal Neonatal Med. 2015;28(4):426-430. https://doi.org/ 10.3109/14767058.2014.918600.
2015;28(4):426-430. https://doi.org/ 10.3109/14767058.2014.918600.
Кардымон О.Л., Кудрявцева А.В. Молекулярно-генети-ческие методы для исследования микробиома кишечника // Российский журнал гистроэнтерологии, гепато-логии, колопроктологии. — 2016. — № 26(4). — С. 4-13. [Kardymon OL, Kudryavtseva AV. Molecular genetic methods for intestinal microbiome investigation. Rossiyskiy zhurnal gistroenterologii, gepatologii, koloproktologii. 2016;(26(4)):4-13. (In Russ.)]
Приказ Министерства здравоохранения РФ от 9 июня 2003 г. № 231 «Об утверждении отраслевого стандарта «Протокол ведения больных. Дисбактериоз кишечника». [Order No 231 Ministry of Health Russia «Ob utverzhdenii otraslevogo standarta ‘Protokol vedeniia bol’nyh. Disbakterioz kishechnika’ «, dated 2003 June 9. (In Russ.)]. Доступно по: https://normativ.kontur.ru/document?moduleId = 1&docu-mentId = 62571. Ссылка активна на 15. 07.2019. Попов Д.А., Овсеенко С.Т., Осипов Г.А., Вострикова Т.Ю. Ускоренный способ идентификации возбудителей бак-териемий с применением метода газовой хромато-масс-спектрометрии // Клиническая лабораторная диагностика. — 2013. — № 5. — С. 54-58. [Popov DA, Ovse-yenko ST, Osipov GA, Vostrikova TYu. The express mode of identification of agents of bacteriemias using the technique of gas chromatography-mass spectrometry. Klin lab diagn. 2013;(5):54-58. (In Russ.)]
07.2019. Попов Д.А., Овсеенко С.Т., Осипов Г.А., Вострикова Т.Ю. Ускоренный способ идентификации возбудителей бак-териемий с применением метода газовой хромато-масс-спектрометрии // Клиническая лабораторная диагностика. — 2013. — № 5. — С. 54-58. [Popov DA, Ovse-yenko ST, Osipov GA, Vostrikova TYu. The express mode of identification of agents of bacteriemias using the technique of gas chromatography-mass spectrometry. Klin lab diagn. 2013;(5):54-58. (In Russ.)]
Гапон М.Н., Зарубинский В.Я., Полищук И.С., Каплиен-ко Л.П. Местный цитокиновый статус у беременных с дисбактериозом кишечника // Medicus. — 2016. -№ 6. — С. 58-61. [Gapon MN, Zarubinsky VYa, Poli-shchuk IS, Kaplienko LP. Local cytokine status in pregnant women with intestinal dysbiosis. Medicus. 2016;(6):58-61. (In Russ.)]
Савченко Т.Н., Хашукоева А.З., Камоева С.В., и др. Взаимосвязь микробиоценоза слизистых генитального и пищеварительного трактов у женщин с невынашиванием беременности // Лечение и профилакти-
I
2019 T°»68
ка. — 2013. — № 2. — С. 36-42. [Savchenko TN, Khashu-koyeva AZ, Kamoyeva SV, et al. The relationship of micro-biocenosis of mucous membranes of genital and digestive systems with miscarriage in women. Lechenie i profilaktika. 2013;(2):36-42. (In Russ.)]
— 2013. — № 2. — С. 36-42. [Savchenko TN, Khashu-koyeva AZ, Kamoyeva SV, et al. The relationship of micro-biocenosis of mucous membranes of genital and digestive systems with miscarriage in women. Lechenie i profilaktika. 2013;(2):36-42. (In Russ.)]
27. Карпеев С.А. Малоизученные аспекты привычного невынашивания беременности // Актуальные вопросы педиатрии и перинатологии: сборник работ, посвященный 35-летию ФГБУ «СЗФМИЦ им. В.А. Алмазова» / под ред. Д.О. Иванова, В.П. Новиковой, И.А. Леоновой. — СПб.: ИнформМед, 2015. — С. 69-85. [Karpeev SA. Maloizu-chennye aspekty privychnogo nevynashivaniya beremen-nosti. In: Aktual’nye voprosy pediatrii i perinatologii: sbornik rabot, posvyashchennyi 35-letiyu FGBU «SZFMIC im. V.A. Almazova». Ed. by D.O. Ivanov, V.P. Novikova, I.A. Leonova. Saint Peterburg: InformMed; 2015. Р. 69-85. (In Russ.)]
28. Полищук И.С., Гапон М.Н., Терновская Л.Н. Характер микробиоценоза толстой кишки беременных // Актуальные вопросы диагностики и профилактики инфекционных и паразитарных заболеваний на юге России: Материалы межрегиональной научно-практической конференции с международным участием; Ростов-на-Дону,
13-14 октября 2016 г. — Ростов н/Д, 2016. — С. 274-278. [Polishchuk IS, Gapon MN, Ternovskaya LN. Aktual’nye voprosy diagnostiki i profilaktiki infekcionnyh i parazitarnyh zabolevanii na yuge Rossii. (Conference proceedings) Materialy mezhregional’noi nauchno-prakticheskoi kon-ferencii s mezhdunarodnym uchastiem; Rostov-on-Don, 2016 October 13-14. Rostov-on-Don; 2016. P. 274-278. (In Russ.)]
— Ростов н/Д, 2016. — С. 274-278. [Polishchuk IS, Gapon MN, Ternovskaya LN. Aktual’nye voprosy diagnostiki i profilaktiki infekcionnyh i parazitarnyh zabolevanii na yuge Rossii. (Conference proceedings) Materialy mezhregional’noi nauchno-prakticheskoi kon-ferencii s mezhdunarodnym uchastiem; Rostov-on-Don, 2016 October 13-14. Rostov-on-Don; 2016. P. 274-278. (In Russ.)]
29. Субханкулова С.Ф., Габидуллина Р.И., Газизов Р.М., и др. Взаимосвязь состояния микробиоценоза толстого кишечника с выраженностью системной эндотоксинемии и антиэндотоксиновой защиты у беременных с обсти-пационным синдромом // Казанский медицинский журнал. — 2008. — Т. 89. — № 2. — С. 163-166. [Subhanku-lova SF, Gabidullina RI, Gazizov RM, et al. The relationship of the bowel microflora with expressiveness of systemic endotoxemia and anti-endotoxin protection in pregnant women with constipation. Kazanskiy medicinskiy zhurnal. 2008;89(2):163-166. (In Russ.)]
30. Taddei CR, Cortez RV, Mattar R, et al. Microbiome in normal and pathological pregnancies: a literature overview. Am J Reprod Immunol. 2018;80(2):e12993. https://doi. org/10.1111/aji.12993.
Taddei CR, Cortez RV, Mattar R, et al. Microbiome in normal and pathological pregnancies: a literature overview. Am J Reprod Immunol. 2018;80(2):e12993. https://doi. org/10.1111/aji.12993.
■ Информация об авторах (Information about the authors) _
Александр Александрович Безменко — канд. мед. наук, доцент кафедры акушерства и гинекологии. ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» Минобороны России, Санкт-Петербург.
Андрей Александрович Шмидт — канд. мед. наук, полковник медицинской службы, начальник клиники (начальник кафедры) акушерства и гинекологии, главный гинеколог Минобороны России. ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» Минобороны России, Санкт-Петербург.
Наталья Дмитриевна Садовая — врач акушер-гинеколог клиники акушерства и гинекологии. ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» Минобороны России, Санкт-Петербург. https://orcid.org/0000-0003-3362-4402. SPIN-код: 7063-7367. E-mail: [email protected].
ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» Минобороны России, Санкт-Петербург. https://orcid.org/0000-0003-3362-4402. SPIN-код: 7063-7367. E-mail: [email protected].
Alexandr A. Bezmenko — MD, PhD, Associate Professor.
The Department of Obstetrics and Gynecology, Military Medical
Academy named after S.M. Kirov, Saint Petersburg, Russia.
Andrei A. Schmidt — MD, PhD, Medical Colonel, the Head of the Clinic (the Head of the Department) of Obstetrics and Gynecology, Chief Gynecologist of the Ministry of Defense of Russia. Military Medical Academy named after S.M. Kirov, Saint Petersburg, Russia.
Natalya D. Sadovaya — MD. The Clinic of Obstetrics and Gynecology, Military Medical Academy named after S.M. Kirov, Saint Petersburg, Russia. https://orcid.org/0000-0003-3362-4402. SPIN-code: 7063-7367. E-mail: [email protected].
https://orcid.org/0000-0003-3362-4402. SPIN-code: 7063-7367. E-mail: [email protected].
I Журнал акушерства и женских болезней 2019 Том со Выпуск г ISSN 1684-0461 (Print)
Journal of Obstetrics and Women’s Diseases 2019 Volume 68 Issue 5 ISSN 1683-9366 (Online)
Дисбактериоз во время беременности: принимаем меры — Статьи — Беременность
Фотобанк Лори
Неправильное питание, хронические стрессы, злоупотребление антибиотиками, плохая экология — цена, которую приходится платить каждому жителю мегаполиса за комфорт и возможности большого города. Нарушение микрофлоры кишечника — одно из многочисленных последствий воздействия этих негативных факторов. Сегодня мы расскажем о профилактике и лечении дисбактериоза во время беременности.
Для чего нужна микрофлора?
В человеческом организме обитает более 300 видов бактерий. Полезные лакто- и бифидобактерии «контролируют» количество патогенных микробов и защищают организм от вирусов, участвуют в переваривании пищи, всасывании железа, витаминов и жиров, расщеплении сложных углеводов и белков…
Полезные лакто- и бифидобактерии «контролируют» количество патогенных микробов и защищают организм от вирусов, участвуют в переваривании пищи, всасывании железа, витаминов и жиров, расщеплении сложных углеводов и белков…
Когда «микробный баланс» серьезно нарушен, в кишечнике активно развиваются условно-патогенные микроорганизмы, полезные бифидо- и лактобактерии (в норме преобладающие) отмирают, нарушается обмен веществ, в кровоток поступают нейротоксины, канцерогены и печеночные токсины… Местный иммунитет при дисбактериозе нарушается, снижается противовирусная защита, и ослабленный организм оказывается беззащитным «перед лицом опасности».
Причины дисбактериоза
— антибиотики
Помимо опасных болезнетворных бактерий антибиотики уничтожают и микроорганизмы, необходимые для поддержания баланса микрофлоры.
— нерациональное питание
К сожалению, лишь небольшой процент российских семей может позволить себе органически чистые продукты. «Продпаек» большинства россиян состоит из продуктов, содержащих большее или меньшее количество консервантов, красителей и т.п.
«Продпаек» большинства россиян состоит из продуктов, содержащих большее или меньшее количество консервантов, красителей и т.п.
— излучение бытовых приборов
Некоторые врачи считают, что данный фактор также негативно влияет на состояние микрофлоры.
Как причиной, так и следствием дисбактериоза могут стать такие нарушения как: гастрит и болезни желудочно-кишечного тракта, нарушение солевого и гормонального обмена, аллергия и т.д.
Профилактика
Всевозможные хронические заболевания желательно «пролечивать» в процессе планирования малыша, а не после его зачатия. Во время беременности нужно по возможности отказаться от применения лекарств, в особенности антибиотиков.
Огромное значение имеет и правильное питание мамы — в числе прочих факторов оно обеспечивает нормальное внутриутробное развитие малыша. Попросите лечащего врача порекомендовать вам специальные витаминные комплексы для беременных.
Лечение
Эффективным средством восстановления микроэкологии толстого кишечника сегодня считаются пребиотики. Их уникальное свойство состоит в способности стимулировать рост популяций полезных бактерий.
Их уникальное свойство состоит в способности стимулировать рост популяций полезных бактерий.
Помимо лекарственных средств корректировать состав микрофлоры желудочно-кишечного тракта можно (и нужно) с помощью диеты. Продукты, богатые пищевыми волокнами (полимерами, состоящими из тысяч молекул глюкозы), способствуют восстановлению баланса. В рацион стоит включить хлеб с отрубями, красную смородину, шиповник, бруснику, курагу и укроп, овсяную крупу, морковь и чернослив.
Читайте также:
Витамины для будущей мамы
Пищевые отравления при беременности
Что есть и пить?
Дисбактериоз у детей
Дисбактериоз у детей – явление очень частое. К счастью, диагнозом дисбактериоз кишечника не является, то есть не входит в международную классификацию болезней. Тем не менее, дисбактериоз существует, и в особенности часто у детей.
Что же такое дисбактериоз?
Ребенок, как мы с Вами знаем уже из предыдущих статей, рождается в этом мире абсолютно стерильным. Важным моментом в формировании на коже новорожденного малыша и его слизистых оболочках поверхностной микрофлоры является прохождение ребенка по родовым путям матери и первый контакт с ее кожей, когда младенца акушеры должны выложить на мать. В первые часы жизни новорожденного начинается самое активное заселение поверхностей его тела множеством бактерий, которые в дальнейшем должны сформировать защитный слой везде, где возможен контакт наших с вами оболочек (кожи, слизистого эпителия) с возбудителями опасных инфекций.
Важным моментом в формировании на коже новорожденного малыша и его слизистых оболочках поверхностной микрофлоры является прохождение ребенка по родовым путям матери и первый контакт с ее кожей, когда младенца акушеры должны выложить на мать. В первые часы жизни новорожденного начинается самое активное заселение поверхностей его тела множеством бактерий, которые в дальнейшем должны сформировать защитный слой везде, где возможен контакт наших с вами оболочек (кожи, слизистого эпителия) с возбудителями опасных инфекций.
Если в эти первые часы жизни в организм ребенка попадут помимо условно хороших бактерий еще и не очень хорошие, или патогенные бактерии, то у ребенка с самого момента его появления на свет будет нарушено состояние поверхностной защиты, иными словами, пленка может оказаться с дырками. Через эти слабые места в дальнейшем возможно попадание в организм различных аллергенов, вирусов и бактерий.
Точно также «дырки в защитной пленке» образуются в результате применения различных химиотерапевтических препаратов, прежде всего, антибиотиков.
Отсюда вывод: если мама ребенка во время беременности или во время лактации (кормления грудью), или же сам ребенок сразу после рождения получали антибиотики, дисбактериоз обеспечен.
А как следствие дисбактериоза возникают проблемы с аллергией, вплоть до непереносимости белка материнского молока. В настоящее время уже появились анализы на антитела IgE и IgG грудного ребенка к белку не только коровьего, но даже грудного материнского молока.
Как мы можем вылечить дисбактериоз?
Справедливости ради надо сказать, что вылечить дисбактериоз нельзя, поскольку это не болезнь, как уже написано выше. Но если в микробиологическом анализе кала на дисбактериоз высеиваются патогенные бактерии, то это – не дисбактериоз, а кишечная инфекция, которая лечится, увы, антибиотиками.
Во всех остальных случаях нарушения нормальной микрофлоры кишечника, запомните, дисбактериоз Не лечится антибиотиками!
В настоящее время принято очень много схем лечения дисбактериоза, которые включают различные бактериофаги – специальные вирусы, которые паразитируют на плохих микробах, во все схемы лечения дисбактериоза обязательно входят сорбенты – препараты, связывающие и выводящие из организма токсины патогенных бактерий, а также пищевые аллергены.
Но основным методом лечения дисбактериоза кишечника по-прежнему остается длительный прием пробиотиков, то есть колоний хороших, полезных бактерий, которые очень нужны для правильного пищеварения и профилактики аллергии у детей, кто бы и что Вам не говорил.
Лечение дисбактериоза – это длительный и сложный процесс, но стоит того, чтобы предотвратить у ребенка развитие хронического запора или остановить развитие атопического дерматита.
Самостоятельно нельзя начинать прием никаких препаратов для лечения дисбактериоза, так как любые препараты имеют и плюсы, и минусы, то есть возможные побочные эффекты, и только грамотный врач педиатр, аллерголог илигастроэнтеролог должны подобрать и контролировать необходимый курс лечения.
Лечение запора у беременных в частной клинике
Это одна их самых распространенных, но в тоже время самых деликатных проблем, возникающих как минимум у 50% беременных женщин. В нормальном состоянии опорожнение кишечника должно быть ежедневным и в достаточном объеме. Любые отклонения в этом процессе требуют внимания и корректировки рациона, образа жизни и даже психологического настроя. С физиологической точки зрения, проблемы в работе ЖКТ объясняются и гормональными сдвигами и физиологическими особенностями организма беременной женщины (под воздействием разных процессов в разные фазы беременности ослабляется сокращение гладкой мускулатуры кишечника, кроме того, увеличенная матка сдавливает кишечник и т.п.).
Любые отклонения в этом процессе требуют внимания и корректировки рациона, образа жизни и даже психологического настроя. С физиологической точки зрения, проблемы в работе ЖКТ объясняются и гормональными сдвигами и физиологическими особенностями организма беременной женщины (под воздействием разных процессов в разные фазы беременности ослабляется сокращение гладкой мускулатуры кишечника, кроме того, увеличенная матка сдавливает кишечник и т.п.).
Среди других – немедицинских причин– самыми распространенными можно считать особенности образа жизни женщины: систематический стресс; недостаточная подвижность; нехватка клетчатки; малое количество потребляемой воды (не жидкости!) и/или высокое потребление рафинированных продуктов и продуктов, с большим составом сахара, гомогенизированных жиров и соли (фаст-фуд). «Рафинированные продукты – это очищенные от большей части полезных веществ рафинированные масла, шлифованный рис, белая мука и всем знакомый белый рафинированный сахар плюс фаст-фуд с большим составом сахара, гомогенизированных жиров и соли замедляют процесса усвояемости полезных веществ организмом и прохождение пищи в кишечнике» (Лайма Ланкмане, натуропат, фитотерапевт).
Гомеопаты утверждают, что запоры — это «проблема» не только прямой кишки, «это проблема всего организма в целом и решать ее надо комплексно» (Д.В. Архипова, к.м.н., гомеопат): например, это может быть аллергической реакцией на определенные продукты. Поэтому запор – это в принципе индивидуальная проблема, а индивидуальный подход будет самым эффективным решением проблемы: «2-х одинаковых запоров нет даже у одинаково беременных: у одних они были и до беременности, другие неправильно питались, третьи — не двигались. Все благие пожелания при настоящем запоре сработают лишь в 10% случаев. Единственно правильное решение — полноценный визит к гомеопату, который подойдет к решению возникшей дисгармонии с учетом всех индивидуальных особенностей женщины, посмотрев на нее как на целостную уникальную систему» (А.С. Гавриленко, акушер-гинеколог, к.м.н., гомеопат, рефлексотерапевт).
Сначала о том, как НЕЛЬЗЯ решать проблему запора: беременным женщинам противопоказаны классические слабительные, такие как сена, алое вера и касторовое масло — они могут вызвать преждевременные схватки.
Теперь о том, что МОЖНО и НУЖНО.
ДИЕТА
- Нужно временно исключить молочные продукты. «Основной молочный белок казеин – является одним из самых трудно перевариваемых белков и к тому же сильный аллерген. То, что творог сам по себе способен вызывать запоры, наверное, известно всем. Если вы таким образом решите проблему с запорами, то потом аккуратно вводите в рацион натуральные кисломолочные продукты (желательно без вкусовых добавок и сахара)» (Д.В. Архипова, к.м.н., гомеопат). Беспокоиться о том, что малыш чего-то не дополучит, не стоит – все, что ему нужно он возьмет из «маминых запасов», и вопрос не в количестве съеденного, а в количестве усвоенного организмом мамы. С точки зрения гомеопатии, если хочется – ешьте, нет – заставлять себя не надо, т.к. пищевые пристрастия и отвращения соответствуют нашей конституции, а значит нашим потребностям (естественно, это касается здоровых и полезных пищевых привычек).
- Надо следить за употребляемой жидкостью – а точнее пить достаточное количество чистой воды.
 Объем — от одного до трех литров в день, по желанию, но не менее литра. «Если пить воду не хочется, надо убрать из рациона сладкие напитки и чаи и компенсировать это чистой водой (желательно сырой, артезианского происхождения, приятной на вкус, а еще лучше талой)». (Т.Г.Садовая, акушер, автор лекции «Питание во время беременности»).
Объем — от одного до трех литров в день, по желанию, но не менее литра. «Если пить воду не хочется, надо убрать из рациона сладкие напитки и чаи и компенсировать это чистой водой (желательно сырой, артезианского происхождения, приятной на вкус, а еще лучше талой)». (Т.Г.Садовая, акушер, автор лекции «Питание во время беременности»). - «Обязательны сухофрукты (можно заливать чернослив водой на ночь и утром выпивать настой), и/или выпивать стакан воды утром натощак (можно добавить туда немного лимонного сока) и стакан воды с медом на ночь» (И.С.Арефьева, акушер-гинеколог).
- В рационе должно быть достаточное количество клетчатки: не менее 50% рациона натуральной растительной пищи в сыром и обработанном виде (клетчатка стимулирует работу перистальтики). Это могут быть цельно зерновые крупы, продукты, приготовленные из муки грубого помола, фрукты до приема пищи или в промежутках, овощи, ягоды (та же брусника оказывает помощь при запорах).
- Хорошо влияет на организм ежедневный прием от 1 до 3-х столовых ложек нерафинированных масел.
 «Масло сладкого миндаля (пищевое) обладает выраженным слабительным эффектом и не раздражает стенки кишечника. Оливковое и льняное и масла, а также масло грецкого ореха тоже обладают мягким слабительным эффектом. Не забудьте, что нерафинированные масла нужно хранить в холодильнике (за исключением оливкового), а льняное желательно употребить в пищу в течение месяца после вскрытия бутылки». (О.Л.Банникова, акушер).
«Масло сладкого миндаля (пищевое) обладает выраженным слабительным эффектом и не раздражает стенки кишечника. Оливковое и льняное и масла, а также масло грецкого ореха тоже обладают мягким слабительным эффектом. Не забудьте, что нерафинированные масла нужно хранить в холодильнике (за исключением оливкового), а льняное желательно употребить в пищу в течение месяца после вскрытия бутылки». (О.Л.Банникова, акушер). - Добавьте в рацион продукты питания, богатые магнием, такие как, зеленые листовые овощи, грецкие орехи и миндаль семена подсолнечника (нежареные, и желательно предварительно замоченные на 5-7 часов), зеленая гречиха и шпинат. «Можно попробовать такой рецепт — 1 чайную ложку семян льна замочить в ½ стакане теплой воды и оставить на несколько часов. После чего съесть просто так или добавить в кашу, суп» (Л.Ланкмане, натуропат, фитотерапевт).
- Можно попробовать потреблять больше продуктов питания, нормализующих баланс кишечной флоры – таких как кефир (желательно домашний), мисо-суп, квашеная капуста.

- Не следует увлекаться крепким чаем, черным кофе, какао, шоколадом, белым хлебом, мучными и слизистыми супами, манной кашей, черникой. Все эти продукты так же, как и еда всухомятку, обладают закрепляющим действием. На время проблем с ЖКТ лучше соблюдать раздельное дробное питание, пить жидкость минут за 15 до еды или некоторое время спустя и т.п. – то есть максимально облегчить усвоение употребляемой пищи. Следите за тем, чтобы не было перекосов — ежедневный рацион должен быть сбалансированным.
КАК ПОМОЧЬ
- Непродолжительное время можно попить ферментативные препараты. Если это препараты животного происхождения – не больше 7 дней, растительные ферменты можно принимать дольше. Можно принимать пробиотики – полезные кишечные бактерии, способствующие пищеварению. Длительный прием этих биопрепаратов не только нормализует кишечную флору, но и способствует менее выраженному проявлению дисбактериоза у новорожденного ребенка. (Д.В.Архипова, гомеопат, к.
 м.н., педиатр)
м.н., педиатр) - Проверьте у доктора уровень железа — на фоне его дефицита, также возможны нарушения в работе кишечника. «Но имейте в виду, что некоторые железосодержащие БАД, к сожалению, лишь могут ухудшить это состояние (не говоря уже про лекарственные формы). Лучше добавить продукты питания, богатые железом, такие как миндаль, кедровые орехи, абрикосы, авокадо, семена подсолнечника и тыквы, зародыши пшеницы» (Л. Ланкмане, натуропат, фитотерапевт).
- Свежевыжатые соки, разведенные 1 к 1 с водой за 15 минут до еды, стимулируют выработку ферментов поджелудочной железой и самым естественным образом способствуют пищеварению. (Д.В.Архипова, гомеопат, к.м.н., педиатр)
- Пить горячую – насколько возможно — воду натощак, немного спустя съесть пол банана, долго разжевывая и обильно размачивая его слюной до жидкой кашицы (банан обязательно должен быть спелым!). (О.Л. Банникова, акушер).
- Начиная со второго триместра, можно пользоваться эфирными маслами: базилик экзотический (Ocimum basilicum по латыни), сосна приморская (Pinus Pinaster), саро (Cinnamosma fragrans, Saro), розовое дерево (Aniba rosaeodora).
 «Масла должны быть только пищевые, хорошего качества! Не рекомендуется применять эфирные масла первые 3 месяца беременности. 1й состав — взять 1 капля базилика, 2 капли сосны на маленький кусочек сахара или мед и пососать под языком утром натощак. 2й состав — базилик 30 капель, розовое дерево 20 капель, саро 10 капель и 40 капель масла абрикосовой косточки или любого другого пищевого нерафинированного масла. Перемешать. Употреблять по 3 капли этой смеси под язык на сахаре или меде утро и вечер перед едой 5-7 дней или как есть необходимость». ОБЯЗАТЕЛЬНО уточните при покупке аромамасел, есть ли информация на упаковке, о том, что данное масло можно употреблять в пищу. (О.Л.Банникова, акушер)
«Масла должны быть только пищевые, хорошего качества! Не рекомендуется применять эфирные масла первые 3 месяца беременности. 1й состав — взять 1 капля базилика, 2 капли сосны на маленький кусочек сахара или мед и пососать под языком утром натощак. 2й состав — базилик 30 капель, розовое дерево 20 капель, саро 10 капель и 40 капель масла абрикосовой косточки или любого другого пищевого нерафинированного масла. Перемешать. Употреблять по 3 капли этой смеси под язык на сахаре или меде утро и вечер перед едой 5-7 дней или как есть необходимость». ОБЯЗАТЕЛЬНО уточните при покупке аромамасел, есть ли информация на упаковке, о том, что данное масло можно употреблять в пищу. (О.Л.Банникова, акушер) - Если это не помогает, можно попробовать использовать непродолжительное время «Дюфалак».
ОБРАЗ ЖИЗНИ
Достаточное количество двигательной активности, плавание в бассейне. Ходьба пешком не менее одного часа. Но нагрузки следует увеличивать постепенно. Для начала одно занятие должно составлять не более 30 минут. Шаг должен быть медленным, обувь удобной, а маршрут лучше проложить подальше от автомобильных дорог. Гимнастика для беременных не менее 30 мин ежедневно. В качестве гимнастики наш инструктор по йоге для беременных Светлана Шнырова советует несколько простых упражнений:
Шаг должен быть медленным, обувь удобной, а маршрут лучше проложить подальше от автомобильных дорог. Гимнастика для беременных не менее 30 мин ежедневно. В качестве гимнастики наш инструктор по йоге для беременных Светлана Шнырова советует несколько простых упражнений:
- прогибы позвоночника в позе кошки (стоя на четвереньках),
- попеременные подъемы ног из положения сидя на полу с опорой на руки,
- определенные виды мягких скруток позвоночника из положения сидя или лежа,
- также могут помочь дыхательные упражнения, например, несколько циклов глубокого дыхания животом.
Во время занятий следует внимательно следить за своим самочувствием и при возникновении любого дискомфорта сразу выходить из позы. И следите за тем, как реагирует на упражнения ваш малыш.
Эти упражнения стимулируют работу кишечника, улучшают кровообращение в брюшной полости, помогают наладить регулярный стул. В целом к проблеме запоров нужно подходить комплексно, утром больше пить воды, отрегулировать питание, больше двигаться, гулять, плавать, заниматься йогой.
Дисбактериоз при беременности, причины и последствия
Дисбактериоз – это патологическое состояние желудочно-кишечного тракта, которое связано с развитием условно-патогенной и патогенной микрофлоры кишечника. Причинами данного состояния может быть общее снижение иммунитета или попадание патогенной микрофлоры.
Обычно при проведении ранней, адекватной терапии, удается быстро купировать данное состояние. К сожалению, врачи сталкиваются с немалым количеством проблем, если они диагностируют дисбактериоз при беременности. Проблема заключается в том, что беременность накладывает ряд ограничений на выбор метода лечения.
Дисбактериоз при беременности – причины и последствия
Дисбактериоз у беременных встречается относительно нечасто, однако многие пациентки обращаются со схожими жалобами, которые связаны с физиологическим протеканием беременности. Проблема заключается в том, что на более поздних сроках начинается интоксикация продуктами метаболизма плода, которые в редких случаях могут вызывать схожие клинические проявления.
Нередко дисбактериоз кишечника при беременности становится последствием заражения или чрезмерного развития патогенной и условно-патогенной микрофлоры – стрептококковой, стафилококковой, протейной и других инфекцией. Беременность значительно ослабляет иммунитет женщины, не давая ей полноценно бороться с микроорганизмами.
Стоит понимать, что лечение имеет ряд ограничений, так как необходимо максимально снизить токсический эффект на плод, особенно на ранних стадиях.
Так, например, значительно ограничен выбор антибактериальных и противогрибковых средств, а также ряд других препаратов, которые могут применяться для симптоматического лечения.
Понимание причин дисбактериоза во время беременности может значительно обезопасить роженицу от подобных проблем. В первую очередь проблемы возникают из-за нарушения рациона питания и нарушения правил личной гигиены. Многие беременные женщины не обращают достаточно внимания на то, что они едят, и как они это делают. Другим фактором риска является неадекватная антибиотикотерапия в период до наступления беременности и наличие разнообразных нарушений желудочно-кишечного тракта: гастриты, диарея, запоры, мелкоочаговые язвенные процессы и т.д. Именно поэтому при планировании беременности необходимо проводить полноценное обследование организма для выявления и решения имеющихся патологий.
Особенно опасен дисбактериоз влагалища, так как со временем патологическая микрофлора может активно распространяться, и в некоторых редких случаях приводить к сепсису плода. По этой причине данная форма дисбактериоза является противопоказанием для наступления беременности – необходимо для начала провести полноценное лечение.
Непременно, можно забеременеть при дисбактериозе влагалища, однако последствия могут быть весьма плачевными.
Дисбактериоз при беременности – симптомы и лечение
Дисбактериоз при беременности имеет практически идентичные симптомы, что и у других групп пациентов. Стоит понимать, что данная патология чаще всего развивается постепенно, не вызывая острых вспышек. Именно по этой причине необходимо тщательно следить за состоянием своего здоровья и вовремя проводить профилактические и диагностические мероприятия.
Чаще всего дисбактериоз кишечника у беременных проявляется постепенным нарастанием дискомфорта в желудочно-кишечном тракте, непереносимостью некоторых пищевых продуктов, метеоризмом, запорами или диареей. Конечно, данные симптомы могут свидетельствовать о раннем токсическом проявлении плода на организм женщины, однако если они постоянно постепенно нарастают, то стоит начать бить тревогу. Кроме того, порой на фоне расстройства ЖКТ могут появляться различные аллергические реакции на коже в виде локальных покраснений, появлением папул и т.п. Некоторые женщины предпочитают в качестве симптоматического лечения начинать прием противоаллергических препаратов, однако длительный их прием не только приводит к интенсивному развитию дисбактериоза, но и к токсическому эффекту как на организм будущей матери, так и плода.
Лечение дисбактериоза у беременных должно проводиться лишь под постоянным наблюдением лечащего врача. Помните, что любое, даже самое незначительное, нарушение функционирования организма женщины может привести к непоправимому воздействию на плод.
В качестве диагностической процедуры женщине назначают бактериологическое исследование кала для количественной и качественной оценки микрофлоры кишечника, а также обязательный тест на чувствительность микрофлоры к антибиотикам.
Если в ходе исследования были обнаружены представители патологической микрофлоры кишечника, то принимается решение о проведении дальнейшего антибактериального лечения. Проблема заключается в том, что плод чрезвычайно чувствителен к антибиотикам, поэтому их применение весьма ограничено. В первую очередь стараются помочь женщинам назначением пробиотиков и пребиотиков, которые должны нормализовать и подавить рост и развитие патогенных микроорганизмов.
Другим, относительно эффективным и безопасным, методом является применение кишечных антисептиков. Данный вид препаратов принимается перорально, однако из-за своего сложного химического строения он не способен всасываться в кишечнике, а действует локально, как обычный антисептик. Это средство эффективно подавляет рост, развитие и размножение бактерий на ранних стадиях, что благоприятно влияет на общее состояние беременной женщины.
Последней мерой, помимо антибиотиков, является применение бактериофагов, которые являются вирусами бактерий. Они способны поражать и уничтожать только определенный вид микроорганизмов, не оказывая токсического или какого-либо еще эффекта на ткани желудочно-кишечного тракта.
Прогнозы дисбактериоза кишечника у беременных
Стоит понимать, что любое инфицирование организма беременной женщины может быть фатальным для плода. Немалая опасность грозит плоду на ранних сроках беременности, так как именно в этот период происходят активные процессы гисто и органогенеза.
Недопустимо влиять фармакологическими или любыми другими факторами на данный процесс, так как нарушения данного процесса невозможно будет исправить в будущем.
На более поздних сроках, особенно в последнем триместре, опасность гораздо ниже, так как практически все процессы завершены и экзогенные факторы не могут нанести значительный вред. Не смотря на этот факт, необходимо помнить, что опасность токсического эффекта на плод или раннего разрешения беременности все еще остается.
Для того, чтобы максимально обезопасить беременность, необходимо внимательно следить за состоянием своего здоровья и проводить профилактику кишечного и иных видов дисбактериозов. В первую очередь необходимо следить за соблюдением правил личной гигиены и планом своего питания.
Вы, как роженица, должны получать достаточное количество молочнокислых продуктов для поддержания оптимальной рН кишечника, а также обеспечит нормофлору достаточным количеством субстрата для собственных метаболических целей. Возможно употребление пребиотиков, которые также нормализуют внутреннюю среду желудочно-кишечного тракта, однако не стоит злоупотреблять пробиотиками, так как они могут создать чрезмерную микробную нагрузку на Вашу иммунную систему.
Почему так важно анализировать микробиоту кишечника во время беременности?
Микробиота кишечника важна для здоровья человека также во время беременности . Давайте узнаем, как кишечные микроорганизмы влияют на это драгоценное время жизни женщины.
Что такое кишечная микробиота?
В нашем кишечнике обитают миллиарды микроорганизмов, в частности бактерии. Это сообщество, называемое кишечной микробиотой , играет ключевую роль в усвоении питательных веществ, иммунной функции и, в целом, поддержании благополучия.Микробиота кишечника, также известная как кишечная флора , особенно распространена в толстой кишке, где каждый грамм фекалий содержит 100 миллиардов бактерий.
Состав кишечной микробиоты уникален для каждого человека. Это зависит как от внутренних факторов , таких как возраст, так и от внешних факторов, таких как диета. Внешние факторы могут значительно изменить баланс микробиоты кишечника, играя роль в развитии ряда заболеваний. Вот почему важно выявлять дисбиозы (то есть изменения микробиоты кишечника): это позволяет воздействовать на внешние факторы для их коррекции.
Микробиота кишечника при беременности
Беременность — это время, когда в организме женщины происходят глубокие изменения. Некоторые (например, иммунологические) необходимы для размещения ребенка в утробе матери; другие (метаболические и гормональные) необходимы для его роста. Эндокринологические, метаболические и иммунологические изменения, происходящие во время беременности, влияют также на кишечную флору. Некоторые изменения микробиоты кишечника полезны для здоровья матери и ребенка, в то время как другие могут быть связаны с осложнениями беременности или поставить под угрозу развитие микробиоты кишечника ребенка.
В течение первого триместра микробиота кишечника аналогична составу небеременной женщины. В течение следующих месяцев уровни Faecalibacterium (бактерии с противовоспалительной активностью) и разнообразие микроорганизмов уменьшаются, тогда как уровни Proteobacteria и Actinobacteria увеличиваются. Среди них — полезные для здоровья бактерии, которые играют важную роль в защите от патогенов, укреплении кишечного барьера и метаболизма питательных веществ.
Риски, связанные с дисбактериозом кишечника во время беременности
Может увеличиваться проницаемость кишечника беременных.Это способствует так называемой бактериальной транслокации , феномену, с помощью которого микроорганизмы материнского происхождения могут достигать плода; на самом деле микробы были обнаружены в пуповинной крови, околоплодных водах и меконии. Более того, предполагается, что кишечник новорожденного во время родов заселяется материнскими микробами.
Дисбактериоз кишечника матери может способствовать чрезмерному увеличению веса во время беременности и связан с повышенным риском гестационного диабета. Более того, в случае материнского дисбактериоза ребенок может унаследовать виды бактерий, связанные с патологиями или с нежелательными последствиями для здоровья, такими как диабет, аллергия или развитие ожирения.
Анализ кишечной микробиоты при беременности
По всем этим причинам во время беременности очень важно, чтобы гарантировать матери хороший состав и разнообразие кишечной микробиоты . Вот почему Bioscience Institute предлагает беременным женщинам МИКРОБАЛАНС — тест для анализа генома кишечной микробиоты для изучения состава кишечной микробиоты.
Для получения дополнительной информации о тесте посетите веб-страницу MICROBALANCE или позвоните нам по телефону +971 (0) 4 375 7220.
Ссылки
— Нуриэл-Охайон М. и др. Микробные изменения во время беременности, родов и младенчества. Front Microbiol. 2016 14 июля; 7: 1031. DOI: 10.3389 / fmicb.2016.01031
— Эдвардс С.М. и др. Микробиом кишечника матери во время беременности. MCN Am J Matern Child Nurs. 2017 ноябрь / декабрь; 42 (6): 310-317. Doi: 10.1097 / NMC.0000000000000372
— Стаут М.Дж. и др. Выявление внутриклеточных бактерий в базальной пластинке плаценты человека при доношенных и преждевременных сроках беременности. Am J Obstet Gynecol.2013 Март; 208 (3): 226.e1-7. doi: 10.1016 / j.ajog.2013.01.018
— Макино Х. Штаммы бифидобактерий в кишечнике новорожденных происходят от их матерей. Здоровье пищевых продуктов Biosci Microbiota. 2018; 37 (4): 79-85. DOI: 10.12938 / bmfh.18-011.
— Milani C. et al. Первые микробные колонизаторы кишечника человека: состав, деятельность и последствия для здоровья кишечной микробиоты младенцев. Microbiol Mol Biol Rev.2017 ноябрь 8; 81 (4). pii: e00036-17. DOI: 10.1128 / MMBR.00036-17
границ | Микробные изменения во время беременности, родов и младенчества
Введение
Беременность — это замечательный биологический процесс, включающий одновременные изменения многих физиологических систем, поддерживающих развитие здорового потомства.Эти изменения включают гормональные изменения, увеличение веса, модуляцию иммунной системы и другие, которые необходимо синхронизировать, чтобы сохранить здоровье как матери, так и потомства (Dunlop et al., 2015). Хотя о некоторых гормональных и метаболических изменениях, связанных с беременностью, известно уже несколько десятилетий (Kumar and Magon, 2012), драматические изменения в составе микробиома, происходящие во время беременности, были оценены только недавно.
При изучении роли микробиоты во время беременности очень важно учитывать стадию, на которой начинается существенное взаимодействие между хозяином и его микробами.Другими словами, когда развивающийся плод впервые сталкивается с микробами? Хотя более 100 лет назад была выдвинута гипотеза о том, что мы рождаемся свободными от микробов (Tissier, 1900), и до сих пор многие врачи верят в нее, многочисленные свидетельства ставят под сомнение эту гипотезу и предполагают, что присутствие бактерий уже существует в плодном теле. -плацентарный блок (Hu et al., 2013; Aagaard et al., 2014). Было также показано, что способ родов, вагинальный или путем кесарева сечения, оказывает влияние на исходную микробиоту новорожденного, которая затем значительно изменяется в результате питания ребенка и общей окружающей среды в течение первых 2 лет жизни до стабилизации.
В этом обзоре мы описываем выраженные микробные изменения, которые происходят у беременных женщин, а также даем обзор первоначального воздействия микробиоты на плод — от плаценты до рождения и младенчества. Мы предполагаем, что соответствующая микробиота необходима для здорового раннего развития, поддержания беременности и первых лет детства. Более того, мы предполагаем, что изменения в микробиоме человека глубоко связаны с физиологическим статусом хозяина, и что эти ассоциации развивались на протяжении совместной эволюции микробиома и хозяина, чтобы обеспечить улучшенную приспособленность.Следовательно, понимание роли микробиома на протяжении всей беременности и раннего развития, а также его роли в здоровье и болезнях имеет большое значение для открытия новых направлений исследований, разработки концепций развития и, возможно, даже для предложения новых терапевтических подходов.
Микробиом
В человеческом теле обитает уникальная микробная популяция, включая бактерии, археи, грибы и вирусы. Различия в составе микробиоты на каждом участке тела формируются различными условиями окружающей среды, такими как pH, уровень кислорода, доступность питательных веществ, влажность и температура, что позволяет различным популяциям процветать и выполнять разные функции при взаимодействии с человеком-хозяином (Ursell и другие., 2012). Эти микробные сообщества оказывают большое влияние на здоровье хозяина, влияя на его метаболизм (Turnbaugh et al., 2006), иммунитет (Naik et al., 2012) и гормоны (Neuman et al., 2015). Большинство микробов в организме человека обитают в кишечнике, являясь приютом для сотен видов бактерий (Lozupone et al., 2012), из которых доминирующими бактериальными типами являются Firmicutes и Bacteroidetes (Rajilic-Stojanovic et al., 2009). Кроме того, кожа, влагалище и полость рта представляют собой важные ниши для различных бактериальных сообществ, которые вносят вклад в иммунную систему за счет защиты от потенциальных патогенов (Naik et al., 2012).
Широкий спектр факторов может вызвать изменения в составе микробиоты (так называемый дисбиоз). Дисбактериоз обычно связан с пагубными последствиями и может иметь долгосрочные последствия, приводящие к заболеванию. Примеры болезненных состояний, связанных с дисбактериозом, включают ожирение, воспалительное заболевание кишечника (ВЗК), диабет и метаболический синдром (Spor et al., 2011). Альтернативно, существуют естественные изменения, которые происходят в микробном составе, ассоциированном с хозяином, на протяжении всего развития хозяина — от младенчества до раннего детства, от молодых до пожилых людей и во время беременности.Хотя некоторые из этих изменений могут казаться идентичными изменениям, наблюдаемым в болезненных состояниях, в их точном контексте развития, они не приводят к заболеваемости, а, скорее, способствуют фитнесу и выживанию и, следовательно, могут считаться полезными.
Методы анализа бактериальных сообществ включают методы культивирования, которые ограничены только подмножеством легко культивируемых видов, и более часто используемые методы секвенирования следующего поколения, включая исследования генов 16S рРНК и метагеномику. Анализ данных с помощью этих методов может предоставить информацию об относительной численности различных микробов в образце, а также о расчетах микробного разнообразия как в пределах одного образца (альфа-разнообразие), так и между разными образцами (бета-разнообразие).Дополнительные методы проверки микробных ролей и функций включают метатранскриптомику, метаболомику и использование моделей животных, свободных от микробов.
Большая часть данных, включенных в этот обзор, сосредоточена на бактериальных членах микробиома, поскольку они являются наиболее изученными на сегодняшний день. Тем не менее, становится все более очевидным, что археи, дрожжи, грибы и вирусы также влияют на своих хозяев, и мы считаем, что будущие исследования покажут их важность и роль в беременности и в раннем периоде жизни.
Физиологические изменения во время беременности
Во время беременности женский организм претерпевает гормональные, иммунологические и метаболические изменения, чтобы поддерживать рост и развитие плода (Kumar and Magon, 2012). В этот период уровни секретируемых гормонов (особенно прогестерона и эстрогенов) резко повышаются, и происходят серьезные изменения в иммунном ответе (Kumar and Magon, 2012). Иммунные изменения являются сложными и могут быть названы иммунной модуляцией, поскольку, с одной стороны, необходима определенная степень иммунного подавления, чтобы принять растущий плод, несущий свою собственную развивающуюся иммунную систему, тогда как, с другой стороны, должен сохраняться строгий иммунитет. для защиты матери и плода от инфекций.В то время как многие считают беременность противовоспалительным состоянием, другие считают беременность многоступенчатым процессом, включающим стадии воспаления при имплантации и родах и противовоспалительные стадии в середине беременности, когда плод быстро растет (Mor and Cardenas, 2010).
Во многих отношениях метаболические изменения, связанные с беременностью, аналогичны изменениям, возникающим при метаболическом синдроме, включая увеличение веса, повышенный уровень глюкозы в крови натощак, инсулинорезистентность, непереносимость глюкозы, слабое воспаление и изменения уровня метаболических гормонов. (Fuglsang, 2008; Newbern, Freemark, 2011; Emanuela et al., 2012; Кумар и Магон, 2012).
Наряду с эндокринными, метаболическими и иммунными изменениями, о которых говорилось выше, во время беременности наблюдаются заметные изменения микробиоты в различных частях тела. Эти изменения обсуждаются ниже, являются предметом настоящего обзора и суммированы на рисунке 1. Однако важно понимать изменения микробиоты в полном контексте всех физиологических изменений, происходящих одновременно, поскольку должны существовать регуляция и перекрестная связь между путями. .
Рисунок 1. Изменения микробиома во время беременности . Текст и стрелки относятся к: общим изменениям (розовый), изменениям в конкретной таксономии (зеленый) и разнообразию сообществ (оранжевый).
Изменения микробиоты кишечника во время беременности
Здоровая беременность характеризуется увеличением бактериальной нагрузки и глубокими изменениями в составе кишечной микробиоты (Collado et al., 2008; Koren et al., 2012). В первом триместре беременности микробный состав кишечника аналогичен составу здоровых небеременных женщин.Однако с первого по третий триместр состав кишечной микробиоты резко меняется. Эти изменения характеризуются увеличением численности представителей филы актинобактерий и протеобактерий, а также сокращением индивидуального богатства (альфа-разнообразие; Корен и др., 2012). Кроме того, уровни Faecalibacterium , бактерии, продуцирующей бутират с противовоспалительной активностью, которая истощается у пациентов с метаболическим синдромом (Haro et al., 2015), значительно снижается в третьем триместре беременности.Межсубъектное разнообразие (бета-разнообразие) увеличивается в третьем триместре в сочетании с увеличением веса, нечувствительностью к инсулину и более высокими уровнями фекальных цитокинов, что отражает воспаление (Koren et al., 2012).
В попытке выявить роль микробных профилей в третьем триместре, трансплантация фекалий была использована для передачи образцов фекальных микробиот в первом и третьем триместре стерильным (GF) мышам и проверки их физиологических эффектов. После переноса кишечной микробиоты в третьем триместре мышей GF, мыши прибавили в весе, у них развилась инсулинорезистентность и у них был более выраженный воспалительный ответ по сравнению с мышами, которым трансплантировали первый триместр (Koren et al., 2012). Эти данные прямо демонстрируют, что микробные компоненты активно способствуют изменениям иммунологии хозяина, а также метаболизма, напоминая изменения, наблюдаемые при метаболическом синдроме. Однако, в отличие от метаболического синдрома, бактериальный состав и физические параметры в третьем триместре беременности оказывают положительное и существенное влияние на беременность и способствуют здоровой беременности и надлежащему развитию плода. Как увеличение веса во время беременности необходимо для удовлетворения потребностей растущего плода, так и воспалительное состояние и нечувствительность к инсулину.Некоторые из предложенных механизмов, с помощью которых микробиота кишечника играет роль в увеличении веса хозяина во время беременности, включают повышенное всасывание глюкозы и жирных кислот, повышенную секрецию фактора адипоцитов, индуцированную голоданием, индукцию катаболических путей и стимуляцию иммунной системы (Collado et al. ., 2008; Корен и др., 2012).
На микробиоту кишечника во время беременности влияют не только внутренние сигналы, но и факторы окружающей среды, в первую очередь диета. В недавнем исследовании на мышах Gohir et al.(2015) продемонстрировали, что диета матери до и во время беременности влияла на микробиоту кишечника. Самки мышей, получавших пищу с высоким содержанием жиров в периконцептивный период и во время беременности, демонстрировали изменения в микробиоте кишечника на более поздних сроках беременности, в отличие от мышей, получавших обычную пищу (Gohir et al., 2015). Состояние ожирения также коррелировало с микробным составом во время беременности человека (Collado et al., 2008). Bacteroides и Staphylococcus , как было показано, значительно выше в фекалиях беременных женщин с избыточным весом по сравнению с таковыми с нормальным весом (Collado et al., 2008). Кроме того, у беременных женщин с избыточным весом и ожирением было обнаружено, что определенные метаболические гормоны, включая инсулин, желудочный ингибиторный полипептид (GIP) и адипокины, коррелируют с изменениями численности бактерий, усиливая связь между микробиотой и метаболическими гормонами во время беременности (Gomez-Arango и др., 2016). Интересно, что было показано, что индекс массы тела матери до беременности (ИМТ) коррелировал с составом микробиоты кишечника новорожденного у потомства, родившегося через естественные родовые пути, но не родившегося с помощью кесарева сечения (Mueller et al., 2016). В целом, большинство исследований показали значительные изменения микробиоты кишечника во время беременности с корреляцией с исходным весом и диетой, увеличением веса, воспалением и метаболическими параметрами. Исключением является недавнее лонгитюдное исследование 49 женщин, выборка которых проводилась еженедельно, во время беременности и ежемесячно после родов. Это исследование не обнаружило резких изменений во время беременности или после родов в составе кишечной микробиоты или показателях богатства (DiGiulio et al., 2015). Это подтверждает тот факт, что необходимы дополнительные исследования, чтобы понять влияние беременности на микробиоту кишечника.
Влияние антибиотиков, вводимых во время беременности, на микробиом было изучено на крысах (Khan et al., 2016). Было показано, что использование антибиотиков категории B (азитромицин, амоксициллин и цефаклор) во время беременности увеличивает относительное количество Proteobacteria и Enterobacter в кале, одновременно снижая относительное количество Firmicutes и Lactobacillus . Более того, антибиотики во время беременности значительно сократили бактериальное разнообразие и способствовали увеличению веса.Другое исследование показало, что лечение материнскими антибиотиками во время беременности и кормления мышей снижает адаптивные противовирусные иммунные ответы у детенышей мышей, что свидетельствует о широком иммунном эффекте на потомство (Gonzalez-Perez et al., 2016). Наиболее поразительно то, что неабсорбируемые антибиотики, вводимые беременным мышам, изменили поведение потомства таким образом, что они проявили низкую двигательную активность в возрасте 4 недель и меньшую исследовательскую активность в центральных областях в возрасте 4 и 8 недель. Однако эти поведенческие фенотипы изменились, когда щенки были выкормлены контрольными матерями, начиная с первого дня постнатального развития (Tochitani et al., 2016).
Наконец, интересно понять, каковы последствия состава материнского микробиома во время беременности для потомства с точки зрения прибавки в весе, иммунитета и здоровья младенца. Исследование на крысах с ожирением, вызванным диетой, показало, что лечение пребиотиками олигофруктозы во время беременности и кормления грудью изменяет микробиом слепой кишки потомства, а также предотвращает увеличение ожирения как у самок, так и у потомства (Paul et al., 2016). Однако трудно определить, был ли основной эффект в этом случае во время беременности или в период кормления грудью.Исследование, в котором пробиотики вводили беременным женщинам за 14 дней до кесарева сечения, выявило модуляцию детской микробиоты, что предполагает ранний материнский эффект на микробиоту потомства (Rautava et al., 2012a). Это же исследование также продемонстрировало корреляцию между материнскими пробиотиками и изменениями в экспрессии генов Toll-подобных рецепторов в плаценте и младенческом меконии. Более того, была выдвинута гипотеза, что воздействие микробов во время беременности может иметь большое значение для предотвращения аллергических заболеваний у потомства.Предлагаемые механизмы включают в себя иммунорегулируемый эпигенетический импринтинг и бактериальную транслокацию во время беременности от матери к потомству, обучение иммунной системы адекватному ответу на патогены и комменсалы после рождения (Abrahamsson et al., 2015). Соответственно, в исследовании, в котором матери с аллергическим заболеванием и атопической сенсибилизацией получали пробиотики в течение последних 2 месяцев беременности и первых 2 месяцев лактации, наблюдалось снижение риска экземы у потомства по сравнению с лечением плацебо (Rautava et al., 2012б). В другом исследовании было показано, что материнская микробиота формирует иммунную систему потомства. Детенышей мышей, рожденных от матерей GF, и матерей GF, колонизированных бактериями во время беременности, сравнивали с точки зрения экспрессии иммунных генов и количества врожденных клеток. У детенышей колонизированных матерей GF было обнаружено повышенное количество врожденных лимфоидных клеток кишечной группы 3, мононуклеарных клеток F4 / 80 + CD11c + и повышенная экспрессия гена эпителиального антибактериального пептида (Rautava et al., 2012b).
Послеродовой период также характеризуется значительными изменениями в микробиоте, и сообщалось, что по крайней мере через 1 месяц после рождения микробиота матери еще не возвращается к исходному уровню (Koren et al., 2012). Только несколько исследований изучали эти временные рамки, поэтому было бы интересно выяснить, как долго длится послеродовой переходный период и произойдет ли когда-либо возврат к исходным микробным популяциям. Поскольку послеродовой период также связан с резкими гормональными изменениями, включая значительное снижение уровней прогестерона и эстрогена, было бы интересно проверить прямое влияние гормональных изменений на микробиом.
Микробиота влагалища во время беременности
Микробиота влагалища человека является ключевым компонентом системы защиты от микробных и вирусных инфекций, обеспечивая защиту от болезней (Туровский и др., 2011). В вагинальном микробиоме преобладают многие виды, включая Lactobacillus и представителей Clostridiales, Bacteriodales и Actinomycetales (Aagaard et al., 2012). В пределах рода Lactobacillus наиболее часто выделяются следующие виды: Lactobacillus gasseri, Lactobacillus crispatus, Lactobacillus jensenii и Lactobacillus iners , которые способствуют различным аспектам здоровья влагалища.В частности, эти продуцирующие молочную кислоту бактерии могут создавать барьер против проникновения патогенов, поддерживая низкий pH (<4,5) и выделяя метаболиты, которые играют важную роль в подавлении бактериальных и вирусных инфекций в урогенитальном тракте (Martin et al., 1999 ; Маклин и Розенштейн, 2000). Напротив, было обнаружено, что значения pH около 5,0 коррелируют с вагинозом (Ravel et al., 2011).
Как и в кишечнике, микробиом влагалища претерпевает значительные изменения во время беременности, включая значительное уменьшение общего разнообразия, повышение стабильности (состав сообщества со временем меняется) и обогащение видами Lactobacillus (Aagaard et al., 2012). Это коррелирует со снижением pH влагалища и увеличением вагинального секрета (Prince et al., 2014a). Было обнаружено, что микробный состав влагалища различается в зависимости от гестационного возраста, в то время как сообщества на более поздних стадиях беременности напоминают таковые в небеременном состоянии (Aagaard et al., 2012). Доминирующий вид Lactobacillus во время беременности варьируется в зависимости от этнической группы; в то время как L. jensenii преимущественно встречается у женщин азиатской и кавказской национальности, L.gasseri отсутствует в выборках от чернокожих женщин (MacIntyre et al., 2015).
Исследование микробиоты влагалища беременных и небеременных афроамериканок показало, что во время беременности одним из изменений является преобладание одного вида Lactobacillus над другими (Romero et al., 2014a). Это может быть связано с тем, что некоторые виды Lactobacillus обладают бактерицидной активностью по отношению к другим видам, обеспечивая их преобладание и низкую изменчивость, что может помочь в защите от инфекций во время беременности (Spurbeck and Arvidson, 2010).
Напротив, недавнее исследование DiGiulio et al. (2015) не выявили каких-либо значительных изменений микробных компонентов влагалища на протяжении беременности. Однако они обнаружили явные различия в послеродовом периоде, когда сообщества влагалища были более похожи на сообщества кишечной микробиоты, при этом Lactobacillus были заменены различными анаэробными бактериями, включая Peptoniphilus, Prevotella и Anaerococcus . Эти различные изменения могут сохраняться в течение года после родов (DiGiulio et al., 2015). Послеродовой вагинальный микробиом также характеризовался постепенным истощением видов Lactobacillus , повышенным альфа-разнообразием и обогащением бактерий, связанных с вагинозом, таких как Actinobacteria , у 40% субъектов через 6 недель после рождения (в отличие от только 2% испытуемых во время беременности; MacIntyre et al., 2015).
Микробиота полости рта во время беременности
Микробиом полости рта включает до 600 различных видов, включая стрептококков, лактобациллы, стафилококки, коринебактерии и т. Д., находящиеся в различных микросредах полости рта (зубы, язык, небо и т. д., Dewhirst et al., 2010). При сравнении численности семи распространенных видов бактерий в полости рта небеременных женщин на ранних, средних и поздних сроках беременности общее количество жизнеспособных микробов на всех этапах беременности было выше, чем у небеременных женщин. , особенно на ранних сроках беременности (Fujiwara et al., 2015), а уровни патогенных бактерий Porphyromonas gingivalis и Aggregatibacter actinomycetemcomitans в поддесневой бляшке были значительно выше на ранних и средних сроках беременности, по сравнению с обычными бактериями. группа беременных (Fujiwara et al., 2015). Эти результаты были дополнительно подтверждены в дополнительном исследовании, показавшем более высокие уровни A. actinomycetemcomitans во втором и третьем триместрах беременности по сравнению с небеременными женщинами (Borgo et al., 2014). Кроме того, уровни Candida были значительно выше на средних и поздних сроках беременности по сравнению с небеременными женщинами, что еще раз демонстрирует более высокую распространенность пародонтальных патогенов во время беременности.
Несмотря на то, что были предприняты некоторые попытки выяснить механизмы, с помощью которых беременность приводит к изменениям в составе полости рта, эти пути остаются неясными.Было высказано предположение, что прогестерон и эстроген влияют на микробиоту во время беременности, но эти эффекты не были полностью расшифрованы и напрямую не доказаны, за исключением того, что эстрогены усиливают инфекцию Candida (Kumar, 2013; Fujiwara et al., 2015). Вполне вероятно, что общее состояние иммунитета во время беременности играет роль, приводящую к увеличению микробной нагрузки в полости рта. Интересно, что между заболеваниями полости рта и осложнениями и исходами беременности были предложены многочисленные корреляции, как описано ниже.
Микробиота плаценты
Плацента — один из наиболее плохо изученных органов человека, особенно с точки зрения присутствия в ней микробов. До недавнего времени считалось, что плод и плацента не содержат микробов и что такая стерильная среда необходима для защиты плода от инфекций. Считалось, что случаи заражения плаценты были вызваны инфекцией, происходящей из нижних отделов половых путей (Goldenberg et al., 2000). Однако несколько линий доказательств предполагают присутствие бактерий в самой нормальной плаценте.
В 1982 году Коваловски и др. были первыми, кто описал присутствие аэробных бактерий в 16% протестированных образцов плаценты, используя культуральный подход, и пришли к выводу, что бактерии могут быть обнаружены в плаценте без каких-либо гистологических свидетельств хориоамнионита (Kovalovszki et al., 1982). С тех пор в нескольких дополнительных отчетах описывались бактерии в плаценте (Goldenberg et al., 2000; Dominguez-Bello et al., 2010; Hyman et al., 2014; Romero et al., 2014a; MacIntyre et al., 2015). Используя метод полногеномного секвенирования (WGS) образцов от 320 субъектов, Aagaard et al. сообщили, что плацента содержит уникальный микробиом (Aagaard et al., 2014). При характеристике микробного сообщества плаценты основным типом были Proteobacteria, и по сравнению со всеми другими органами состав был наиболее похож на микробиоту полости рта, включая такие виды, как Prevotella tannerae и Neisseria (Aagaard et al., 2014) . Сходство микробиоты полости рта и плаценты предполагает, что бактерии могут переходить из полости рта в плаценту, что, возможно, объясняет многочисленные наблюдения женщин с заболеваниями пародонта, у которых повышен риск осложнений беременности (Gibbs et al., 1992; Джефферсон, 2012; Майсорекар и Цао, 2014; Prince et al., 2014b). Кроме того, в нескольких исследованиях (рис. 1) с использованием методов культивирования и ПЦР были обнаружены микробы в околоплодных водах и пуповинной крови у здоровых бессимптомных женщин, а также у женщин с осложнениями беременности (DiGiulio et al., 2010a, b; Romero et al. ., 2014б). Важно отметить, что микробная плотность, присутствующая в плаценте, очень мала, что требует точной проверки во всех случаях, что результаты исследований не связаны с контаминацией.Это особенно верно в отношении образцов, в которых плацента была собрана после вагинальных родов и, следовательно, подвержена загрязнению из родовых путей, в отличие от образцов, в которых плацента была собрана во время кесарева сечения стерильным способом.
Тем не менее, эти первоначальные результаты ставят дополнительные вопросы относительно локализации бактерий внутри плаценты и присутствия разных бактериальных популяций в разных участках плаценты, поскольку плацента включает разные ниши, как с точки зрения взаимодействия с материнскими, так и с материнскими клетками.кровообращение плода и уровень кислорода. Другой интригующий вопрос заключается в том, необходимы ли микробные компоненты для здорового развития и функционирования плаценты, и лежащие в основе механизмы этих эффектов.
Роль дисбактериоза и инфекций в осложнениях беременности
Осложнения беременности, такие как преэклампсия, эклампсия, внутриутробная гибель плода, ограничение внутриутробного роста (ЗВУР), отслойка плаценты и преждевременные роды, наблюдаются примерно в каждой шестой беременности и могут повлиять на здоровье и выживаемость как матери, так и плода ( Куйович, 2004).Хотя эти осложнения затрагивают многих беременных женщин во всем мире, этиология в большинстве случаев неизвестна (Rizzo and Arduini, 2009). Уже давно предполагается, что бактериальные инфекции могут быть связаны с осложнениями беременности и даже могут вызывать эти состояния (Seong et al., 2008). С появлением исследований микробиома и осознанием того, что изменения в составе материнского микробиома происходят во время беременности, было высказано предположение, что могут существовать корреляции между присутствующими микробными сообществами и здоровьем беременных (Mysorekar and Cao, 2014).Таким образом, начался поиск микробных маркеров, связанных с осложнениями беременности. В связи с этим важно различать нормальные и здоровые микробные изменения, происходящие во время беременности, и нежелательные изменения, которые могут быть связаны с состояниями осложнений беременности.
При изучении микробиома влагалища Romero et al. не обнаружили никакой связи между степенью альфа-разнообразия и исходами беременности (Romero et al., 2014a), в то время как два других исследования продемонстрировали корреляцию между высоким альфа-разнообразием и преждевременными родами (Hyman et al., 2014). ДиДжиулио и его коллеги определили кандидатские вагинальные сообщества на ранних сроках беременности, которые были значительно связаны с повышенным уровнем преждевременных родов (DiGiulio et al., 2015). Эти сообщества включают более высокую численность Gardnerella и Ureaplasma , более низкую численность Lactobacillus sp. И более высокое альфа-разнообразие. Механически аномальные изменения микробиоты влагалища во время беременности, такие как снижение уровня Lactobacillus sp., может привести к инфекциям и выработке провоспалительных цитокинов и простагландинов, которые могут вызывать сокращения матки и ослаблять оболочки плода (Park et al., 2005; Lajos et al., 2008). Кроме того, наличие определенных грибов, таких как колонизация влагалища Candida albicans , даже при бессимптомном течении, коррелирует с более высокими показателями преждевременных родов (Farr et al., 2015). Хотя эффекты не являются прямыми, было высказано предположение, что помимо здоровых изменений, связанных с беременностью, дисбактериоз кишечника может вызывать осложнения беременности, нарушая адаптацию матери (Zhang et al., 2015).
Корреляция между инфекциями полости рта и осложнениями беременности была показана в различных исследованиях (Zi et al., 2014). Было показано, что материнские заболевания пародонта увеличивают риск преждевременных родов (Offenbacher et al., 2006). Хотя поначалу связь между инфекциями полости рта и осложнениями беременности может показаться надуманной; существует несколько механизмов, с помощью которых может возникать такая связь. Одна теория утверждает, что липополисахариды (ЛПС) грамотрицательных пародонтопатических бактерий, таких как Porphyromonas gingivalis , могут увеличивать воспалительные медиаторы и продукцию простагландинов, что приводит к преждевременным родам (ElAttar, 1976; Kim and Amar, 2006).В качестве альтернативы было высказано предположение, что гематогенное распространение микробов полости рта на плаценту может быть причиной преждевременных родов (Aagaard et al., 2014).
Наконец, по мере накопления доказательств наличия микробиома плаценты возникает вопрос, различаются ли эти бактериальные сообщества в случаях осложнений беременности, таких как преждевременные роды. При сравнении популяций бактерий в плаценте при преждевременных и доношенных родах более высокая численность нескольких таксонов, таких как Burkholderia, Streptosporangium и Anaeromyxobacter , была обнаружена в плаценте недоношенных беременных, а Paenibacillus — в плаценте в срок (Romero et al., 2014а). Однако при использовании гистологических красителей не было обнаружено значительных различий между недоношенной и доношенной плацентой (Stout et al., 2013). Хотя некоторые из этих исследований указывают на изменения в бактериальном составе плаценты, связанные с преждевременными родами, необходимы дополнительные исследования для подтверждения микробных сигнатур плаценты, связанных с преждевременными родами.
Ранняя бактериальная колонизация плода
До недавнего времени считалось, что новорожденные рождаются полностью свободными от микробов и что первоначальная колонизация кишечника новорожденного происходит во время рождения.Однако несколько исследований показывают, что колонизация плода начинается еще до рождения. В 2008 году Хименес и др. Перорально инокулировали беременным мышам генетически маркированный штамм Enterococcus faecium и впоследствии смогли изолировать эту бактерию из мекония (первого стула) потомства, полученного путем кесарева сечения (в неинокулированной контрольной группе меченые бактерии не были обнаружены; Хименес и др., 2008). Это открытие означает, что материнские бактерии могут проникать в желудочно-кишечный тракт плода.Однако прямые доказательства микробной колонизации плода, а также потенциальные механизмы передачи бактерий от матери к плоду до сих пор неизвестны. В исследовании на людях, в котором беременные матери получали пробиотики по сравнению с контрольной группой плацебо, бактериальные изменения были обнаружены в младенческом меконии и плаценте (Rautava et al., 2012b), что еще раз указывает на пренатальный эффект на микробный состав. Представление о ранней микробной колонизации плода предполагает, что с самого начала развития существуют двойные взаимодействия между развивающимся хозяином и микробиотой, и что существует некоторый тип раннего наследования материнских микробных компонентов.
Микробиом мекония
Как и плацента и плод, меконий в прошлом считался стерильным (Koleva et al., 2015), однако несколько недавних исследований с использованием различных методов показали наличие бактериальных популяций, включая Enterococcus, Escherichia, Leuconostoc, Lactococcus и Streptococcus (Dominguez-Bello et al., 2010; Gosalbes et al., 2013; Hansen et al., 2015) По сравнению с образцами фекалий взрослых младенцев меконий демонстрирует меньшее видовое разнообразие, более высокую вариабельность между субъектами и обогащение Proteobacteria за счет уменьшения количества Bacteroidetes (Hu et al., 2013). Ardissone et al. (2014) обнаружили корреляцию между гестационным возрастом новорожденного и микробным составом мекония. В частности, роды Enterobacter, Enterococcus, Lactobacillus, Photorhabdus и Tannerela были более многочисленны в меконии недоношенных детей (Ardissone et al., 2014).
Способ доставки и микробиом новорожденного
В 2013 г. Gosalbes et al. не обнаружили значительных различий между микробиотой мекония у новорожденных, родившихся через влагалище и кесарево сечение (кесарево сечение) (Gosalbes et al., 2013). Однако несколько дополнительных исследований показали явное влияние способа доставки на состав кишечной микробиоты новорожденных. Как правило, кишечная микробиота новорожденных, рожденных естественным путем, сначала заселяется бактериями из материнского влагалища, характеризующимися обогащением родов Prevotella, Sneathia и Lactobacillus , а также бактерий, присутствующих в кишечнике матери (Mackie et al. , 1999; Домингес-Белло и др., 2010). Напротив, микробиота кишечника младенцев, рожденных посредством кесарева сечения, указывает на относительное сходство с материнской кожей и микробиотой полости рта, в которой преобладают Propionibacterium, Corynebacterium и Streptococcus (Backhed et al., 2015; MacIntyre et al., 2015). Младенцы, рожденные в результате кесарева сечения, также демонстрируют отложенную колонизацию типа Bacteroidetes и более низкое альфа-разнообразие в течение первых 2 лет жизни (Jakobsson et al., 2014). Однако различия в видовом разнообразии между способами доставки уменьшаются через 4 месяца и почти исчезают к 12 месяцам (Backhed et al., 2015). Было также обнаружено, что микробиом новорожденных, рожденных с помощью кесарева сечения, содержит более высокую долю бактериальных генов устойчивости к антибиотикам по сравнению с младенцами, рожденными через естественные родовые пути.Это, вместе с более высокой численностью Staphylococcus у новорожденных с кесаревым сечением по сравнению с естественными родами, может объяснить, почему 64–82% зарегистрированных случаев метициллин-резистентных кожных инфекций Staphylococcus aureus (MRSA) у новорожденных возникают при C- секция рожала младенцев (Центры профилактики заболеваний, 2006 г.).
Интересно, что способ родоразрешения также влияет на микробиом ротовой полости младенца (Lif Holgerson et al., 2011). Сразу после родов микробные сообщества ротовой полости новорожденных с кесаревым сечением и вагинальных родов напоминают микробные сообщества кожи или влагалища матери соответственно (Dominguez-Bello et al., 2010). Кроме того, было показано, что популяции бактерий в полости рта различаются в возрасте 3 месяцев у детей с кесаревым сечением и естественных родов. Как правило, больше бактериальных таксонов было обнаружено у младенцев, рожденных естественным путем, по сравнению с младенцами, рожденными с помощью кесарева сечения, при этом Slackia exigua обнаруживается только у младенцев, рожденных с помощью кесарева сечения. В другом исследовании младенцев, инфицированных S. mutans , вовлеченных в кариес зубов, детей, перенесших инфекцию с помощью кесарева сечения, почти на 1 год раньше, чем у младенцев, родившихся через естественные родовые пути, и генотип этих бактерий был аналогичен генотипу их матери (Li et al., 2005).
Было высказано предположение, что нарушение передачи вагинальных бактерий через кесарево сечение может иметь долгосрочные медицинские последствия: несколько исследований показали, что родоразрешение с помощью кесарева сечения увеличивает частоту глютеновой болезни (Decker et al., 2010; Marild et al. , 2012), ожирение и астма (Kero et al., 2002). Более того, введение пробиотиков (включая Lactobacillus sp.) С рождения до 6-месячного возраста снижает частоту возникновения аллергии у детей в возрасте 5 лет у детей с кесаревым сечением, но не у детей, рожденных естественным путем (Kuitunen et al., 2009). Однако ни в одном из этих исследований напрямую не проверялась роль бактерий, колонизирующих новорожденного, в развитии болезни. Способ доставки также может влиять на созревание иммунной системы. Якобссон и др. обнаружили более низкие уровни связанных с Т-хелперными клетками хемокинов CXCL10 и CXCL11 в крови младенцев, рожденных с помощью кесарева сечения, по сравнению с младенцами, рожденными естественным путем. Более того, бактерии из рода Bacteroides (которые более многочисленны после вагинальных родов) влияют на зрелость иммунной системы (Kelly et al., 2004), предполагая, что кесарево сечение может привести к иммунным нарушениям.
Явные различия между микробиомным составом новорожденных, рожденных с помощью кесарева сечения, и новорожденных, рожденных через влагалище, побудили ученых подвергнуть младенцев, рожденных с помощью кесарева сечения, воздействию влагалищных жидкостей, содержащих микробиоту при рождении, и проверить их влияние на микробный состав ребенка в срок до 30 дней (Домингес). -Bello et al., 2016). При сравнении бактериальных сообществ кишечника, ротовой полости и кожи новорожденных, рожденных кесаревым сечением, у детей, подвергшихся воздействию влагалищных жидкостей, было выявлено значительно больше бактерий, связанных с влагалищем, что делает их состав более похожим на младенцев, рожденных естественным путем.
Таким образом, очевидно, что способ рождения влияет на состав микробиома новорожденного (рис. 2). До сих пор остается неясным, оказывают ли эти различные бактериальные сообщества в младенчестве долгосрочные эффекты с точки зрения состава микробиома, метаболизма и общего состояния здоровья.
Рис. 2. Изменения микробиома новорожденного . Текст и стрелки относятся к: изменениям в конкретной таксономии (зеленый), общим изменениям (розовый) и разнообразию сообществ (оранжевый). (A) Текст относится к изменениям в вагинальных родах по сравнению сКесарево сечение (В) . Текст относится к изменениям в грудном молоке по сравнению с кормлением смесью.
Микробиота кишечника в течение первых 2 лет жизни
С момента рождения младенцы приобретают микробы из окружающей среды, из своего рациона и от окружающих их людей. Поэтому первые 2 года жизни, которые характеризуются огромными изменениями в питании, новым воздействием окружающей среды и созреванием иммунной системы, оказывают сильное влияние на микробиоту младенца.Двумя наиболее важными факторами, влияющими на формирование микробиоты кишечника младенца, являются способ рождения и кормление (грудное молоко или смесь, а затем твердая пища; рис. 2). В первые месяцы жизни микробиота кишечника менее стабильна, чем в более позднем детстве, и происходят изменения в филогенетическом разнообразии. Koenig et al. показали, наблюдая за младенцем в течение 2,5-летнего периода, что альфа-разнообразие кишечной микробиоты младенца со временем постепенно увеличивается (Koenig et al., 2011). Однако высокое β-разнообразие, наблюдаемое при рождении (которое выше, чем наблюдаемое у взрослых), уменьшается к 12-месячному возрасту (Backhed et al., 2015). С точки зрения функции, в возрасте 12 месяцев наблюдается большее сходство с метагеномом кишечника матери по сравнению с новорожденными, что означает, что микробиом созревает в течение первого года жизни. В частности, по мере того, как в течение первого года меняются источники питания и энергии, меняются и компоненты использования энергии микробами: в то время как микробные гены, необходимые для разложения сахаров из молока, наиболее распространены в 4 месяца, микробные гены, разлагающие сложные сахара и крахмал, более распространены в 12 месяцев (Backhed et al., 2015).
Кроме того, болезни и изменения окружающей среды, такие как лихорадка, лечение антибиотиками и изменения в диете, могут вызывать большие изменения в бактериальном составе и численности некоторых таксономических групп (Koenig et al., 2011). Различия в микробиоте на протяжении развития здорового младенца могут быть нанесены на график, чтобы показать постепенные изменения в зависимости от возраста. Было показано, что недоедание у маленьких детей влияет на их микробиом, заставляя его напоминать микробиом на более ранних стадиях развития (Smith et al., 2013).
Микробиом человеческого молока
Грудное молоко вырабатывается матерью для нормального и здорового развития ее потомства. Эта жидкость считается оптимальным источником всех факторов питания, в которых нуждается младенец, и содержит много белков, липидов и 200 типов олигосахаридов (углеводов), которые не встречаются в других местах (Kunz et al., 2000). До недавнего времени преобладала парадигма, согласно которой молоко стерильно; однако недавние исследования доказали обратное, показав, что грудное молоко не только содержит бактерии, но и является основным источником создания «здорового микробиома» у новорожденного (Heikkila and Saris, 2003; Martin et al., 2007, 2009). В 2011 году Hunt et al. обнаружили, что микробиом молока чрезвычайно разнообразен, и предложили «основной микробиом грудного молока» после обнаружения девяти операционных таксономических единиц (OTU) последовательно по образцам от 16 субъектов (Hunt et al., 2011). Дальнейшая характеристика показала, что микробный состав меняется в течение периода лактации. Наиболее доминирующими бактериями в молозиве (первое молоко, вырабатываемое на поздних сроках беременности и содержащее антитела), были Weisella, Leuconostoc, Staphylococcus, Streptococcus и Lactococcus , тогда как образцы молока, собранные через 1–6 месяцев после родов, содержали ротовую полость. родственные бактерии, такие как Veillonella, Leptotrichia и Prevotella , возможно, из-за частого взаимодействия с микробиотой полости рта младенца (Cabrera-Rubio et al., 2012).
Было обнаружено, что вес матери является основным фактором, влияющим на формирование бактериального состава молока. У беременных с ожирением более высокая численность рода Staphylococcus , а именно S. aureus была зарегистрирована в течение первых 6 месяцев лактации, а также более высокая численность Lactobacillus в первый месяц по сравнению с образцами от матерей нормальный вес (Cabrera-Rubio et al., 2012). Интересно, что высокие уровни S. aureus также обнаруживаются в кишечной микробиоте детей с избыточным весом; однако источник этой бактерии пока неясен (Kalliomaki et al., 2008). Необходимы дальнейшие исследования, чтобы определить, могут ли популяции молочных микробов, связанные с материнским ожирением, влиять на вес потомства.
Считается, что источником популяций молочных микробов является кишечник, и считается, что механизм, с помощью которого бактерии перемещаются из кишечника в молочные железы, облегчается гормональными изменениями, которые происходят во время и после беременности. В частности, повышение уровня прогестерона может увеличить проницаемость кишечника, что может способствовать передаче бактерий в кровоток, а затем в молочные железы матери (Jeurink et al., 2013). Будет интересно дополнительно проверить функцию и важность микробиома молока — играют ли эти бактерии роль в метаболизме молока или иммунитете и в какой степени они влияют на микробные популяции младенца.
Влияние грудного вскармливания и смеси на младенцев
Существуют глубокие различия в составе микробиоты кишечника детей, вскармливаемых грудью, и детей, вскармливаемых смесью (суммировано на рисунке 2B). Грудное молоко содержит олигосахариды, сложные углеводы, которые не могут перевариваться младенцем.Однако некоторые из бактерий младенца, включая Bifidobacterium, Lactobacillus и Bacteroides , обладают способностью расщеплять эти олигосахариды до небольших сахаров, которые могут использоваться в качестве источника энергии (например, лактозы), что дает им преимущество перед конкурирующими бактериями ( Sela et al., 2011; Manthey et al., 2014). Оставшиеся небольшие сахара могут дополнительно метаболизироваться гликолитическими микробами, присутствующими в младенце, включая лактат-продуцирующие бактерии, такие как Streptococcus, Staphylococcus и Enterococcus .Эта удивительная совместная эволюция биосинтеза материнского молока и компонентов микробиоты младенца, которые могут его с пользой использовать, улучшает питание молодого холобионта (Bode, 2012).
Исследования последних двух десятилетий показали, что Bifidobacteria являются наиболее многочисленными микроорганизмами в кишечнике грудных детей, тогда как в кишечной микробиоте детей, вскармливаемых смесью, преобладают Enterococci и Clostridia (Balmer and Wharton, 1989). . Кроме того, Bezirtzoglou et al.наблюдали, что кишечник младенца, находящегося на искусственном вскармливании, содержал меньше бактериальных клеток и большее видовое разнообразие по сравнению с кишечником грудного ребенка (Bezirtzoglou et al., 2011).
Неудивительно, что способ кормления (грудное вскармливание или детская смесь) также влияет на микробиом полости рта младенца. Трехмесячные младенцы на грудном вскармливании содержали оральные лактобациллы с антимикробными свойствами, которые не были обнаружены у младенцев, вскармливаемых смесью (Holgerson et al., 2013; Vestman et al., 2013).
Период отлучения с переходом на твердую пищу играет важную роль в формировании бактериального состава кишечника.После отлучения кишечная микробиота младенца обогащается видами, которые преобладают у взрослых, включая Bacteroidetes и Firmicutes из класса Clostridia: Clostridium , Ruminococcus, Faecalibacterium, Roseburia и Anaerostipes (Valles et al., 2014; Backhed et al., 2014; Backhed et al., 2014; Backhed et al., 2014; Backhed et al., 2014; Backhed et al., 2014; Backhed et al., 2014; Backhed et al., 2014; др., 2015). Кроме того, было показано, что уровни короткоцепочечных жирных кислот в кале выше после введения твердой пищи младенцам (Koenig et al., 2011). Переход на твердую пищу, а также повышенное воздействие ксенобиотиков изменяют микробные популяции и обогащают виды, которые способны использовать питательные вещества, такие как углеводы, и участвуют в биосинтезе витаминов и разложении ксенобиотиков, тем самым созревая микробиом кишечника (Backhed et al. ., 2015).
Таким образом, по-видимому, существуют значительные различия в составе микробиоты в зависимости от диеты и режима кормления. Однако необходимы дальнейшие исследования, чтобы полностью понять значение этих различий и проверить, имеют ли они какие-либо долгосрочные эффекты.
Выводы
В этом обзоре мы обсуждаем состав микробиома на трех важнейших стадиях развития: беременность, роды и младенчество. Эти стадии сопровождаются многочисленными физиологическими изменениями, включая изменения гормонального фона, воспаления и метаболических состояний.Беременность и младенчество — это периоды роста и увеличения веса, изменения диеты и изменений компонентов иммунной системы. Сам процесс рождения включает в себя множество одновременных изменений окружающей среды и развития, в том числе отслойку от плаценты, начало дыхания, воздействие воздуха и внешней среды и активное использование желудочно-кишечного тракта. Очевидно, что эти многочисленные события и изменения должны быть синхронизированы, чтобы достичь здорового нормального развития, обеспечивающего жизнь.
Мы описываем значительные изменения микробного состава на различных участках тела (кишечник, влагалище, плацента, грудное молоко и т. Д.)) на протяжении этих процессов развития. Однако предстоит еще много работы, чтобы расшифровать значение этих изменений и их роль в общем процессе, ведущем к здоровой беременности, родам и раннему развитию. Мы считаем, что микробные изменения, наблюдаемые в процессе разработки, имеют большое значение, и что дополнительные исследования позволят решить эту загадку. Однако, возможно, невозможно расшифровать значение изменений без полного контекста развития. Например, во время беременности наблюдаются те же характеристики и изменения, что и при метаболическом синдроме, включая дисбактериоз, воспаление и увеличение веса.В обоих случаях бактерии влияют на метаболизм и иммунитет хозяина; однако контекст развития имеет решающее значение для различения «полезного» характера этих изменений во время беременности, поскольку они способствуют накоплению энергии в жировой ткани и росту плода, в отличие от их «вредного» характера в контексте метаболического синдрома.
Сложные взаимодействия между хозяином и микробиотой во время беременности и раннего развития еще предстоит полностью понять. Большинство исследований, представленных в этом обзоре, являются ассоциативными исследованиями, подчеркивающими изменения в составе, богатстве и разнообразии микробиоты между группами.Однако в нескольких исследованиях анализировалось фактическое влияние микробных изменений на развитие хозяина (например, в экспериментах по пересадке фекалий) или даже на метаболомику и транскрипционные эффекты. Кажется вероятным, что нет простого ответа на вопрос о том, влияет ли микробиом на беременность, роды и раннее развитие или на него влияют, и похоже, что эффекты двунаправленные.
Когда вы думаете о беременности, одним из первых и, возможно, самых важных изменений, которые происходят, являются гормональные изменения.В связи с этим уже было показано, что микробиом влияет как на эндокринную систему, так и на нее. Микробиота обладает способностью производить и секретировать гормоны или аналоги гормонов, а также реагировать на гормоны хозяина и регулировать их. С другой стороны, уровни гормонов хозяина могут влиять на рост бактерий, делая взаимодействие между микробиотой и гормонами двунаправленным. Тем не менее точные данные о влиянии женских гормонов на микробиоту и наоборот все еще необходимы.
Еще одна сложная взаимосвязь обнаружена между микробиомом и иммунной системой.Во время беременности иммунная система должна быть изменена, чтобы обеспечить правильное развитие плода (включая развитие иммунной системы плода), а также предотвратить отторжение плода иммунной системой матери. Иммунная модуляция сильно влияет на микробные компоненты, но они также являются активными участниками системы.
Наконец, микробиом и метаболизм хозяина имеют двойные эффекты. На микробиоту влияет как метаболическое состояние хозяина (включая пищевые компоненты и гормоны хозяина), так и метаболизм хозяина (с точки зрения энергетического гомеостаза, накопления жира и гормональной регуляции).Это может быть продемонстрировано трансплантацией фекалий мышам GF, приводящей к фенотипам, напоминающим метаболический синдром (Harley and Karp, 2012; Koren et al., 2012).
Определение полезных и вредных микробных компонентов и их роли во время беременности, родов, послеродового периода и на раннем этапе развития может иметь чрезвычайно важное значение с точки зрения диеты, лечения антибиотиками, пробиотиков и потенциальных методов лечения болезненных состояний на всех стадиях развития. Следовательно, микробные взаимодействия в это время могут иметь клиническое значение при разработке желаемого типа антибиотиков и / или пробиотиков для беременных женщин или новорожденных.Например, если окажется, что определенные виды микробов в грудном молоке имеют долгосрочную пользу для здоровья, их также можно назначать новорожденным, находящимся на искусственном вскармливании. В качестве альтернативы, лечение пробиотиками или антибиотиками может быть разработано для облегчения состояний, связанных с осложнениями беременности, или, по крайней мере, могут быть определены микробные биомаркеры для ранней диагностики таких состояний. Поэтому мы уверены, что будущие исследования в этих областях предоставят полезные клинические знания, а также более широкое понимание того, что такое здоровые и здоровые.аномальное развитие.
Взносы авторов
MO, HN и OK просмотрели литературу и написали рукопись.
Финансирование
Работа MO и OK была поддержана Международным грантом на реинтеграцию Марии Кюри (FP7-PEOPLE-2013-CIG-630956) и Министерством здравоохранения Государства Израиль (3-0000-10451). HN был поддержан Министерством науки, технологий и космоса Государства Израиль. (3-11714)
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Список литературы
Аагаард, К., Ма, Дж., Энтони, К. М., Гану, Р., Петросино, Дж., И Версалович, Дж. (2014). Плацента содержит уникальный микробиом. Sci. Пер. Med. 6: 237ra65. DOI: 10.1126 / scitranslmed.3008599
PubMed Аннотация | CrossRef Полный текст
Aagaard, K., Riehle, K., Ma, J., Segata, N., Mistretta, T.A., Coarfa, C., et al. (2012). Метагеномный подход к характеристике микробиома влагалища во время беременности. PLoS ONE 7: e36466.DOI: 10.1371 / journal.pone.0036466
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ардиссон, А. Н., де ла Круз, Д. М., Дэвис-Ричардсон, А. Г., Речцигл, К. Т., Ли, Н., Дрю, Дж. К. и др. (2014). Анализ микробиома мекония выявляет бактерии, связанные с преждевременными родами. PLoS ONE 9: e
. DOI: 10.1371 / journal.pone.00PubMed Аннотация | CrossRef Полный текст | Google Scholar
Backhed, F., Roswall, J., Peng, Y., Feng, Q., Jia, H., Kovatcheva-Datchary, P., et al. (2015). Динамика и стабилизация микробиома кишечника человека в течение первого года жизни. Клеточный микроб-хозяин 17, 690–703. DOI: 10.1016 / j.chom.2015.05.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Безирцоглу Э., Циоциас А. и Веллинг Г. В. (2011). Профиль микробиоты в кале новорожденных, находящихся на грудном вскармливании и на искусственном вскармливании, с использованием флуоресценции in situ гибридизации (FISH). Анаэроб 17, 478–482.DOI: 10.1016 / j.anaerobe.2011.03.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Борго, П. В., Родригес, В. А., Фейтоса, А. К., Ксавьер, К. К., и Авила-Кампос, М. Дж. (2014). Связь между состоянием пародонта и поддесневой микробиотой у женщин во время беременности: продольное исследование. J. Appl. Oral Sci. 22, 528–533. DOI: 10.1590 / 1678-775720140164
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кабрера-Рубио, Р., Колладо, М. К., Лайтинен, К., Салминен, С., Изолаури, Э., и Мира, А. (2012). Микробиом грудного молока изменяется во время лактации и определяется весом матери и способом родов. Am. J. Clin. Nutr. 96, 544–551. DOI: 10.3945 / ajcn.112.037382
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Центры профилактики заболеваний (2006 г.). Связанная с сообществом метициллин-резистентная инфекция Staphylococcus aureus среди здоровых новорожденных — Чикаго и округ Лос-Анджелес, 2004 г. MMWR Morb. Mortal Wkly. Реп. 55, 329–332. DOI: 10.1097 / 01.inf.0000226977.41367.58
PubMed Аннотация | CrossRef Полный текст
Колладо, М. К., Изолаури, Э., Лайтинен, К., и Салминен, С. (2008). Отчетливый состав микробиоты кишечника во время беременности у женщин с избыточным и нормальным весом. Am. J. Clin. Nutr. 88, 894–899.
PubMed Аннотация | Google Scholar
Декер, Э., Энгельманн, Г., Финдейзен, А., Гернер, П., Лаасс, М., Ней, Д., и другие. (2010). Кесарево сечение связано с глютеновой болезнью, но не с воспалительным заболеванием кишечника у детей. Педиатрия 125, e1433 – e1440. DOI: 10.1542 / педс.2009-2260
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дьюхерст, Ф. Э., Чен, Т., Изард, Дж., Пастер, Б. Дж., Таннер, А. С., Ю, В. Х. и др. (2010). Микробиом ротовой полости человека. J. Bacteriol. 192, 5002–5017. DOI: 10.1128 / jb.00542-10
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ДиДжиулио, Д.Б., Каллахан, Б. Дж., Мак-Мерди, П. Дж., Костелло, Э. К., Лайелл, Д. Дж., Робачевска, А. и др. (2015). Временные и пространственные изменения микробиоты человека во время беременности. Proc. Natl. Акад. Sci. США 112, 11060–11065. DOI: 10.1073 / pnas.1502875112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ДиДжиулио, Д. Б., Герваси, М., Ромеро, Р., Мазаки-Тови, С., Вайсбух, Э., Кусанович, Дж. П. и др. (2010a). Микробная инвазия амниотической полости при преэклампсии по оценке культивированием и методами, основанными на последовательностях. J. Perinat. Med. 38, 503–513. DOI: 10.1515 / jpm.2010.078
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ДиДжиулио, Д. Б., Ромеро, Р., Кусанович, Дж. П., Гомес, Р., Ким, К. Дж., Сек, К. С. и др. (2010b). Распространенность и разнообразие микробов в околоплодных водах, воспалительная реакция плода и исход беременности у женщин с преждевременным разрывом плодных оболочек перед родами. Am. J. Reprod. Иммунол. 64, 38–57. DOI: 10.1111 / j.1600-0897.2010.00830.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Домингес-Белло, М. Г., Костелло, Э. К., Контрерас, М., Магрис, М., Идальго, Г., Фирер, Н. и др. (2010). Способ доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc. Natl. Акад. Sci. США 107, 11971–11975. DOI: 10.1073 / pnas.1002601107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Домингес-Белло, М.Г., Де Жезус-Лабой, К. М., Шен, Н., Кокс, Л. М., Амир, А., Гонсалес, А. и др. (2016). Частичное восстановление микробиоты младенцев, рожденных после кесарева сечения, посредством вагинального микробного переноса. Nat. Med. 22, 250–253. DOI: 10,1038 / нм 4039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Данлоп, А. Л., Мюлле, Дж. Г., Ферранти, Э. П., Эдвардс, С., Данн, А. Б., и Корвин, Э. Дж. (2015). Материнский микробиом и исходы беременности, влияющие на здоровье младенца: обзор. Adv. Уход за новорожденными 15, 377–385. DOI: 10.1097 / ANC.0000000000000218
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эль-Аттар, Т. М. (1976). Простагландин E2 в десне человека при здоровье и болезни и его стимуляция женскими половыми стероидами. Простагландины 11, 331–341. DOI: 10.1016 / 0090-6980 (76) -6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эмануэла, Ф., Грация, М., Марко де, Р., Мария Паола, Л., Джорджио, Ф., и Марко, Б. (2012). Воспаление как связующее звено между ожирением и метаболическим синдромом. J. Nutr. Метаб. 2012: 476380. DOI: 10.1155 / 2012/476380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фарр А., Кисс Х., Хольцер И., Хуслейн П., Хагманн М. и Петричевич Л. (2015). Влияние бессимптомной вагинальной колонизации Candida albicans на исход беременности. Acta Obstet. Гинеколь. Сканд. 94, 989–996. DOI: 10.1111 / aogs.12697
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fujiwara, N., Tsuruda, K., Iwamoto, Y., Kato, F., Odaki, T., Yamane, N., et al. (2015). Значительное увеличение количества бактерий в ротовой полости в раннем периоде беременности у японских женщин. J. Investig. Clin. Вмятина. DOI: 10.1111 / jicd.12189. [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гиббс, Р.С., Ромеро, Р., Хиллиер, С.Л., Эшенбах, Д.А. и Свит Р. Л. (1992). Обзор преждевременных родов и субклинической инфекции. Am. J. Obstet. Гинеколь. 166, 1515–1528. DOI: 10.1016 / 0002-9378 (92) -n
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гохир В., Уилан Ф. Дж., Суретт М. Г., Мур К., Шерцер Дж. Д. и Слобода Д. М. (2015). Изменения микробиоты кишечника матери, связанные с беременностью, зависят от диеты матери в период зачатия. Кишечные микробы 6, 310–320.DOI: 10.1080 / 194.2015.1086056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гомес-Аранго, Л. Ф., Барретт, Х. Л., Макинтайр, Х. Д., Каллавей, Л. К., Моррисон, М., Нитерт, М. Д., и группа, С. Т. (2016). Связь между микробиомом кишечника и метаболическими гормонами на ранних сроках беременности у женщин с избыточным весом и ожирением. Диабет. DOI: 10.2337 / db16-0278. [Epub перед печатью].
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гонсалес-Перес, Г., Хикс, А. Л., Текиели, Т. М., Раденс, К. М., Уильямс, Б. Л., и Ламуз-Смит, Э. С. (2016). Лечение матери антибиотиками влияет на развитие кишечного микробиома новорожденных и противовирусный иммунитет. J. Immunol. 196, 3768–3779. DOI: 10.4049 / jimmunol.1502322
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Госалбес, М. Дж., Ллоп, С., Валлес, Ю., Мойя, А., Баллестер, Ф., и Францино, М. П. (2013). Типы микробиоты мекония, в которой преобладают молочнокислые или кишечные бактерии, по-разному связаны с экземой у матери и респираторными проблемами у младенцев. Clin. Exp. Аллергия 43, 198–211. DOI: 10.1111 / cea.12063
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хансен, Р., Скотт, К. П., Хан, С., Мартин, Дж. К., Берри, С. Х., Стивенсон, М. и др. (2015). Образцы мекония первого прохождения от здоровых доношенных новорожденных: анализ микробиоты. PLoS ONE 10: e0133320. DOI: 10.1371 / journal.pone.0133320
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аро, К., Гарсия-Карпинтеро, С., Алькала-Диас, Дж. Ф., Гомес-Дельгадо, Ф., Дельгадо-Листа, Дж., Перес-Мартинес, П. и др. (2015). Сообщество кишечных микробов у пациентов с метаболическим синдромом изменяется с помощью диеты. J. Nutr. Biochem. DOI: 10.1016 / j.jnutbio.2015.08.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хейккила, М. П., и Сарис, П. Е. (2003). Ингибирование золотистого стафилококка комменсальными бактериями грудного молока. J. Appl. Microbiol. 95, 471–478. DOI: 10.1046 / j.1365-2672.2003.02002.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Холджерсон, П. Л., Вестман, Н. Р., Клэссон, Р., Оман, К., Домеллоф, М., Таннер, А. С. и др. (2013). Микробный профиль полости рта отличает детей, находящихся на грудном вскармливании, от детей, вскармливаемых смесью. J. Pediatr. Гастроэнтерол. Nutr. 56, 127–136. DOI: 10.1097 / MPG.0b013e31826f2bc6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ху, Дж., Nomura, Y., Bashir, A., Fernandez-Hernandez, H., Itzkowitz, S., Pei, Z., et al. (2013). На разнообразную микробиоту мекония влияет диабетический статус матери. PLoS ONE 8: e78257. DOI: 10.1371 / journal.pone.0078257
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хант, К. М., Фостер, Дж. А., Форни, Л. Дж., Шютте, У. М., Бек, Д. Л., Абдо, З. и др. (2011). Характеристика разнообразия и временной стабильности бактериальных сообществ грудного молока. PLoS ONE 6: e21313. DOI: 10.1371 / journal.pone.0021313
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хайман, Р. У., Фукусима, М., Цзян, Х., Фунг, Э., Рэнд, Л., Джонсон, Б. и др. (2014). Разнообразие вагинального микробиома коррелирует с преждевременными родами. Репродукция. Sci. 21, 32–40. DOI: 10.1177 / 19337188838
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Якобссон, Х. Э., Абрахамссон, Т. Р., Дженмальм, М.К., Харрис, К., Айва, К., Джернберг, К. и др. (2014). Снижение разнообразия кишечной микробиоты, задержка колонизации Bacteroidetes и снижение ответа Th2 у младенцев, рожденных с помощью кесарева сечения. Кишечник 63, 559–566. DOI: 10.1136 / gutjnl-2012-303249
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jeurink, P. V., van Bergenhenegouwen, J., Jimenez, E., Knippels, L.M., Fernandez, L., Garssen, J., et al. (2013). Грудное молоко: источник большей жизни, чем мы себе представляем. Benef. Микробы 4, 17–30. DOI: 10.3920 / BM2012.0040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хименес, Э., Марин, М. Л., Мартин, Р., Одриозола, Дж. М., Оливарес, М., Хаус, Дж. И др. (2008). Действительно ли меконий от здоровых новорожденных бесплоден? Res. Microbiol. 159, 187–193. DOI: 10.1016 / j.resmic.2007.12.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Каллиомаки, М., Колладо, М. К., Салминен, С., и Изолаури, Э. (2008). Ранние различия в составе фекальной микробиоты у детей могут предсказать избыточный вес. Am. J. Clin. Nutr. 87, 534–538.
PubMed Аннотация | Google Scholar
Келли, Д., Кэмпбелл, Дж. И., Кинг, Т. П., Грант, Г., Янссон, Э. А., Куттс, А. Г. и др. (2004). Комменсальные анаэробные кишечные бактерии ослабляют воспаление, регулируя ядерно-цитоплазматическое перемещение PPAR-гамма и RelA. Nat. Иммунол. 5, 104–112. DOI: 10.1038 / ni1018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Керо, Дж., Gissler, M., Gronlund, M. M., Kero, P., Koskinen, P., Hemminki, E., et al. (2002). Способ родов и астма — есть ли связь? Pediatr. Res. 52, 6–11. DOI: 10.1203 / 00006450-200207000-00004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан И., Азхар Э. И., Аббас А. Т., Кумосани Т., Барбур Э. К., Рауль Д. и др. (2016). Метагеномный анализ вызванных антибиотиками изменений микробиоты кишечника на модели беременных крыс. Фронт. Pharmacol. 7: 104. DOI: 10.3389 / fphar.2016.00104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кениг, Дж. Э., Спор, А., Скалфон, Н., Фрикер, А. Д., Стомбо, Дж., Найт, Р. и др. (2011). Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Proc. Natl. Акад. Sci. США 108 (Приложение 1), 4578–4585. DOI: 10.1073 / pnas.1000081107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Колева П.Т., Ким Дж.С., Скотт, Дж. А., Козырский, А. Л. (2015). Микробное программирование здоровья и болезни начинается во время жизни плода. Врожденные дефекты Res. C Эмбрион сегодня 105, 265–277. DOI: 10.1002 / bdrc.21117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Корен, О., Гудрич, Дж. К., Каллендер, Т. К., Спор, А., Лайтинен, К., Бакхед, Х. К. и др. (2012). Ремоделирование кишечного микробиома и метаболические изменения хозяина во время беременности. Ячейка 150, 470–480. DOI: 10.1016 / j.cell.2012.07.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коваловски, Л., Виллани, З., Патаки, И., Везеловский, И., и Надь, З. Б. (1982). Выделение аэробных бактерий из плаценты. Acta Paediatr. Акад. Sci. Подвешенный. 23, 357–360.
PubMed Аннотация | Google Scholar
Куйтунен М., Кукконен К., Юнтунен-Бакман К., Корпела Р., Пусса Т., Тууре Т. и др. (2009). Пробиотики предотвращают IgE-ассоциированную аллергию до 5 лет у детей, родившихся после кесарева сечения, но не во всей когорте. J. Allergy Clin. Иммунол. 123, 335–341. DOI: 10.1016 / j.jaci.2008.11.019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кунц, К., Рудлофф, С., Байер, В., Кляйн, Н., и Штробель, С. (2000). Олигосахариды в материнском молоке: структурные, функциональные и метаболические аспекты. Annu. Rev. Nutr. 20, 699–722. DOI: 10.1146 / annurev.nutr.20.1.699
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лайош, Дж. Дж., Пассини Джуниор, Р., Nomura, M. L., Amaral, E., Pereira, B.G., Milanez, H., et al. (2008). [Бактериальная колонизация шейки матки у женщин с преждевременными родами или преждевременным разрывом плодных оболочек]. Ред. Бюстгальтеры. Ginecol. Акушерство. 30, 393–399. DOI: 10.1590 / S0100-72032008000800004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли Ю., Кауфилд П. В., Дасанаяке А. П., Винер Х. У. и Вермунд С. Х. (2005). Способ родов и другие материнские факторы влияют на приобретение Streptococcus mutans у младенцев. J. Dent. Res. 84, 806–811. DOI: 10.1177 / 1544058400905
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лиф Хольгерсон, П., Харневик, Л., Хернелл, О., Таннер, А. К., и Йоханссон, И. (2011). Способ родов влияет на микробиоту полости рта у младенцев. J. Dent. Res. 90, 1183–1188. DOI: 10.1177 / 0022034511418973
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лозупоне, К.А., Стомбо, Дж. И., Гордон, Дж.И., Янссон, Дж. К., и Найт, Р. (2012). Разнообразие, стабильность и устойчивость микробиоты кишечника человека. Природа 489, 220–230. DOI: 10.1038 / природа11550
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Макинтайр, Д. А., Чандирамани, М., Ли, Ю. С., Киндинджер, Л., Смит, А., Ангелопулос, Н., и др. (2015). Микробиом влагалища во время беременности и в послеродовой период в европейской популяции. Sci. Отчет 5: 8988. DOI: 10.1038 / srep08988
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маки, Р.И., Сгир А. и Гаскинс Х. Р. (1999). Микробная экология развития желудочно-кишечного тракта новорожденных. Am. J. Clin. Nutr. 69, 1035S – 1045S.
PubMed Аннотация | Google Scholar
Манти, К. Ф., Отран, К. А., Экманн, Л., и Боде, Л. (2014). Олигосахариды грудного молока защищают от энтеропатогенного прикрепления Escherichia coli in vitro и колонизации EPEC у грудных мышей. J. Pediatr. Гастроэнтерол. Nutr. 58, 165–168.DOI: 10.1097 / MPG.0000000000000172
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Марилд, К., Стефанссон, О., Монтгомери, С., Мюррей, Дж. А., и Людвигссон, Дж. Ф. (2012). Исход беременности и риск глютеновой болезни у потомства: общенациональное исследование методом случай-контроль. Гастроэнтерология 142, 39.e3–45.e3. DOI: 10.1053 / j.gastro.2011.09.047
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартин, Х. Л., Ричардсон, Б. А., Ньянге, П.M., Lavreys, L., Hillier, S.L., Chohan, B., et al. (1999). Вагинальные лактобациллы, микробная флора и риск заражения вирусом иммунодефицита человека 1 типа и заболеваниями, передающимися половым путем J. Infect. Дис. 180, 1863–1868. DOI: 10.1086 / 315127
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартин Р., Хейлиг Х. Г., Зетендал Э. Г., Хименес Э., Фернандес Л., Смидт Х. и др. (2007). Независимая от культивирования оценка бактериального разнообразия грудного молока среди здоровых женщин. Res. Microbiol. 158, 31–37. DOI: 10.1016 / j.resmic.2006.11.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартин Р., Хименес Э., Хейлиг Х., Фернандес Л., Марин М. Л., Зетендаль Э. Г. и др. (2009). Выделение бифидобактерий из грудного молока и оценка популяции бифидобактерий с помощью ПЦР-денатурирующего градиентного гель-электрофореза и количественной ПЦР в реальном времени. Заявл. Environ. Microbiol. 75, 965–969. DOI: 10.1128 / AEM.02063-08
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маклин, Н. У., и Розенштейн, И. Дж. (2000). Характеристика и выбор видов Lactobacillus для повторной колонизации влагалища женщин с рецидивирующим бактериальным вагинозом. J. Med. Microbiol. 49, 543–552. DOI: 10.1099 / 0022-1317-49-6-543
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мюллер, Н. Т., Шин, Х., Пизони, А., Верланг, И. К., Матте, У., Голдани, М.Z., et al. (2016). Зависимая от способа родов связь между массой тела матери до беременности и микробиомом кишечника новорожденного. Sci. Отчет 6: 23133. DOI: 10.1038 / srep23133
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Naik, S., Bouladoux, N., Wilhelm, C., Molloy, M.J., Salcedo, R., Kastenmuller, W., et al. (2012). Компартментарный контроль кожного иммунитета резидентными комменсалами. Наука 337, 1115–1119. DOI: 10.1126 / наука.1225152
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нойман, Х., Дебелиус, Дж. У., Найт, Р., и Корен, О. (2015). Микробная эндокринология: взаимодействие микробиоты и эндокринной системы. FEMS Microbiol. Ред. 39, 509–521. DOI: 10.1093 / femsre / fuu010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ньюберн, Д., Фримарк, М. (2011). Плацентарные гормоны и контроль материнского метаболизма и роста плода. Curr. Opin. Эндокринол. Диабет Ожирение. 18, 409–416. DOI: 10.1097 / MED.0b013e32834c800d
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оффенбахер, С., Боггесс, К. А., Мурта, А. П., Джаред, Х. Л., Лифф, С., Маккейг, Р. Г. и др. (2006). Прогрессирующее заболевание пародонта и риск преждевременных родов. Акушерство. Гинеколь. 107, 29–36. DOI: 10.1097 / 01.AOG.00001.87012.96
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Парк, J.С., Парк, К. В., Локвуд, К. Дж., И Норвиц, Э. Р. (2005). Роль цитокинов в преждевременных родах и родах. Минерва Гинекол. 57, 349–366.
PubMed Аннотация | Google Scholar
Пауль, Х. А., Бомхоф, М. Р., Фогель, Х. Дж., И Реймер, Р. А. (2016). Вызванные диетой изменения микробиоты кишечника матери и метаболомных профилей влияют на программирование риска ожирения у потомства у крыс. Sci. Отчет 6: 20683. DOI: 10.1038 / srep20683
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Князь, А.Л., Энтони, К. М., Чу, Д. М., и Аагаард, К. М. (2014b). Микробиом, роды и время рождения: больше вопросов, чем ответов. J. Reprod. Иммунол. 104–105, 12–19. DOI: 10.1016 / j.jri.2014.03.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Принс, А. Л., Энтони, К. М., Ма, Дж., И Аагаард, К. М. (2014a). Микробиом и развитие: взгляд матери. Семин. Репродукция. Med. 32, 14–22. DOI: 10.1055 / с-0033-1361818
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раджилич-Стоянович, М., Heilig, H.G., Molenaar, D., Kajander, K., Surakka, A., Smidt, H., et al. (2009). Разработка и применение чипа кишечного тракта человека, филогенетического микрочипа: анализ универсально консервативных филотипов в многочисленной микробиоте молодых и пожилых людей. Environ. Microbiol. 11, 1736–1751. DOI: 10.1111 / j.1462-2920.2009.01900.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раутава С., Колладо М. К., Салминен С. и Изолаури Э.(2012a). Пробиотики модулируют взаимодействие хозяина и микроба в плаценте и кишечнике плода: рандомизированное двойное слепое плацебо-контролируемое исследование. Неонатология 102, 178–184. DOI: 10.1159 / 000339182
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раутава, С., Кайнонен, Э., Салминен, С., и Исолаури, Э. (2012b). Добавки с пробиотиками для матери во время беременности и грудного вскармливания снижают риск экземы у младенца. J. Allergy Clin. Иммунол. 130, 1355–1360.DOI: 10.1016 / j.jaci.2012.09.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Равель, Дж., Гайер, П., Абдо, З., Шнайдер, Г. М., Кениг, С. С., МакКул, С. Л. и др. (2011). Микробиом влагалища женщин репродуктивного возраста. Proc. Natl. Акад. Sci. США 108 (Приложение 1), 4680–4687. DOI: 10.1073 / pnas.1002611107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Риццо, Г., и Ардуини, Д. (2009). Ограничение внутриутробного развития: диагностика и лечение.Обзор. Минерва Гинекол. 61, 411–420.
PubMed Аннотация | Google Scholar
Ромеро Р., Хассан С. С., Гайер П., Тарка А. Л., Фадрош Д. В., Никита Л. и др. (2014a). Состав и стабильность микробиоты влагалища здоровых беременных женщин отличаются от таковых у небеременных женщин. Микробиом 2: 4. DOI: 10.1186 / 2049-2618-2-4
PubMed Аннотация | CrossRef Полный текст
Ромеро Р., Миранда Дж., Чайворапонгса Т., Chaemsaithong, P., Gotsch, F., Dong, Z., et al. (2014b). Стерильное внутриамниотическое воспаление у бессимптомных пациентов с короткой шейкой матки при сонографии: распространенность и клиническое значение. J. Matern. Fetal Neonatal Med. 28, 1–17. DOI: 10.3109 / 14767058.2014.954243
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Села, Д. А., Ли, Ю., Лерно, Л., Ву, С., Маркобаль, А. М., Герман, Дж. Б. и др. (2011). Бактериальный комменсал, ассоциированный с младенцами, использует сиалилолигосахариды грудного молока. J. Biol. Chem. 286, 11909–11918. DOI: 10.1074 / jbc.M110.193359
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сеонг, Х.С., Ли, С.Э., Кан, Дж. Х., Ромеро, Р., Юн, Б. Х. (2008). Частота микробной инвазии амниотической полости и гистологического хориоамнионита у доношенных женщин с интактными плодными оболочками при наличии или отсутствии родов. Am. J. Obstet. Гинеколь. 199, 375.e1–375.e5. DOI: 10.1016 / j.ajog.2008.06.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит, М.И., Яцуненко Т., Манары М. Дж., Трехан И., Мкакося Р., Ченг Дж. И др. (2013). Микробиомы кишечника малавийских пар близнецов не соответствуют квашиоркору. Наука 339, 548–554. DOI: 10.1126 / science.1229000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Спор А., Корен О., Лей Р. (2011). Выявление влияния окружающей среды и генотипа хозяина на микробиом кишечника. Nat. Rev. Microbiol. 9, 279–290. DOI: 10.1038 / nrmicro2540
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Спербек Р.Р., и Арвидсон, К. Г. (2010). Поверхностно-ассоциированные белки Lactobacillus jensenii подавляют прикрепление Neisseria gonorrhoeae к эпителиальным клеткам. Заражение. Иммун. 78, 3103–3111. DOI: 10.1128 / iai.01200-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стаут, М. Дж., Конлон, Б., Ландо, М., Ли, И., Бауэр, К., Чжао, К. и др. (2013). Выявление внутриклеточных бактерий в базальной пластинке плаценты человека при доношенных и преждевременных сроках беременности. Am. J. Obstet. Гинеколь. 208, 226.e1–226.e7. DOI: 10.1016 / j.ajog.2013.01.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тиссье, Х. (1900). Recherches Sur La Flore Intestinale Des Nourrissons (État Normal Et Pathologique) . Тезис. Париж: Дж. Карре и К. Науд.
Точитани, С., Икено, Т., Ито, Т., Сакураи, А., Ямаути, Т., и Мацудзаки, Х. (2016). Введение неабсорбируемых антибиотиков беременным мышам для нарушения микробиоты кишечника матери связано с изменениями в поведении потомства. PLoS ONE 11: e0138293. DOI: 10.1371 / journal.pone.0138293
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тернбо, П. Дж., Лей, Р. Э., Маховальд, М. А., Магрини, В., Мардис, Е. Р., и Гордон, Дж. И. (2006). Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа 444, 1027–1031. DOI: 10.1038 / nature05414
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Урселл, Л.К., Клементе, Дж.К., Райдаут, Дж. Р., Геверс, Д., Капорасо, Дж. Дж., И Найт, Р. (2012). Межличностное и внутриличностное разнообразие связанной с человеком микробиоты в ключевых участках тела. J. Allergy Clin. Иммунол. 129, 1204–1208. DOI: 10.1016 / j.jaci.2012.03.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валлес Ю., Артачо А., Паскуаль-Гарсия А., Феррус М. Л., Госальбес М. Дж., Абеллан Дж. Дж. И др. (2014). Последовательность микробов в кишечнике: направленные тенденции таксономических и функциональных изменений в когорте новорожденных испанских младенцев. PLoS Genet. 10: e1004406. DOI: 10.1371 / journal.pgen.1004406
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вестман Н. Р., Тимби Н., Холджерсон П. Л., Крессирер К. А., Клаессон Р., Домеллоф М. и др. (2013). Характеристика и in vitro свойств оральных лактобацилл у младенцев, находящихся на грудном вскармливании. BMC Microbiol. 13: 193. DOI: 10.1186 / 1471-2180-13-193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зи, М.Ю., Лонго, П. Л., Буэно-Силва, Б., и Майер, М. П. (2014). Механизмы, участвующие в ассоциации между пародонтитом и осложнениями беременности. Фронт. Общественное здравоохранение 2: 290. DOI: 10.3389 / fpubh.2014.00290
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дисбиоз материнской и неонатальной микробиоты, связанный с гестационным сахарным диабетом
Введение
В человеческом теле обитают многочисленные микробы, которые образуют стабильные симбиотические отношения с хозяином и необходимы для здоровья человека.Длинный список болезней связан с дисбалансом микробиоты человека.1 В последние годы большое внимание уделялось микробиоте во время беременности и в раннем периоде жизни, поскольку они очень важны для репродуктивного здоровья2. корреляция между микробиотой влагалища матери и преждевременными родами.3 Кроме того, материнская и неонатальная микробиота может влиять на раннее развитие новорожденных, 4 и может вызвать долгосрочные физиологические последствия в будущем.5 Соответственно, следует предпринять усилия, чтобы понять последствия состояния здоровья матери во время беременности на исходную микробиоту новорожденных и вклад матери.
Сахарный диабет беременных (ГСД) — это заболевание аномальной толерантности к глюкозе, которое впервые возникает и распознается во время беременности. Пероральный тест на толерантность к глюкозе (OGTT), проводимый между 24 и 28 неделями, является золотым стандартом для диагностики этого заболевания.6 GDM распространен во всем мире, а его распространенность в некоторых странах или регионах даже превышает 20% .7 Более серьезно, заболеваемость ГСД продолжает расти, что представляет большую угрозу для здоровья матери и новорожденного. Это было связано с рядом неблагоприятных исходов, включая гестационную гипертензию, сердечно-сосудистые заболевания и преэклампсию у беременных 8, а также макросомию плода, респираторный дистресс-синдром и диабет 2 типа у потомства.9 Более того, диабетический статус матери может вызвать дисбактериоз микробиоты в меконии новорожденных.10 Учитывая, что меконий обычно выводится и собирается через несколько часов после родов, микробы могут накапливаться и воспроизводиться в течение этого периода, микробиота мекония предположительно является результатом послеродовой сбор.11 Однако такие типы образцов, как глоточные аспираты, которые располагаются глубоко в теле новорожденного и могут быть собраны сразу же при рождении, являются идеальным материалом для изучения воздействия GDM на исходную микробиоту.
В этом исследовании мы выполнили ген 16S рРНК и метагеномное секвенирование образцов, собранных из нескольких участков тела 486 беременных китайских женщин и новорожденных в течение нескольких секунд после родов. Наличие или отсутствие GDM было включено для определения вариаций материнской и неонатальной микробиоты, соответствующих состоянию здоровья беременных женщин, а также для иллюстрации основных микробных различий в раннем возрасте и их влияния на результаты для здоровья.
Материалы и методы
Набор субъектов
Беременные женщины и новорожденные были набраны в Пекинской авиационной больнице общего профиля и Народной больнице Вэньчжоу.Беременные женщины с ГСД (ГСД +) были диагностированы врачами-специалистами по результатам ОГТТ и были отобраны в качестве клинической группы. Контрольной группой служили здоровые беременные женщины (GDM-), у которых в анамнезе не было других заболеваний, особенно пародонтита, диабета 2 типа и бактериального вагиноза.
Отбор проб
Отбор проб выполнялся обученными профессионалами в строгих асептических условиях и по единому протоколу. Амниотическая жидкость (5–10 мл на образец) была собрана во время родов.Примерно 0,5–1 мл слюны новорожденного и 2–3 мл глоточного аспирата были взяты стерильными пипетками в течение 60 с после родов до того, как пуповина была разрезана. Примерно 1 г мекония брали стерильной пластиковой ложкой в течение 24 часов, как только у новорожденных появились первые кишечные выделения. Большинство неонатальных образцов было взято у новорожденных после кесарева сечения. Образцы свежей слюны, стула и вагинального секрета были взяты у беременных за 1-2 дня до родов. Влагалищные образцы были взяты из заднего свода под прямой визуализацией с использованием трех мазков.Все образцы помещали в стерильные пробирки или флаконы, сразу же замораживали после сбора при –20 ° C, а затем транспортировали в лабораторию и хранили при –80 ° C до полной экстракции ДНК для последующего секвенирования.
Препарат ДНК
На строго контролируемом, отдельном и стерильном рабочем месте примерно 0,2 мл слюны, глоточного аспирата и амниотической жидкости смешивали с равными объемами PBS и буфера AL Qiagen путем импульсного встряхивания в течение 30 с. Тотальную ДНК экстрагировали в трех экземплярах из суспензии каждого типа образцов с использованием мини-набора QIAamp DNA (Qiagen, Валенсия, Калифорния).Образцы фекалий (~ 200 мг) ресуспендировали в буфере ASL Qiagen и гомогенизировали в течение 2 минут. Тотальную фекальную ДНК экстрагировали из супернатанта с использованием мини-набора QIAamp DNA Stool (Qiagen). Два вагинальных мазка интенсивно встряхивали в 0,5 мл PBS и 0,5 мл буфера Qiagen’s AL в течение 2 минут для ресуспендирования и лизиса микробных клеток. Полученный лизат обрабатывали с использованием мини-набора QIAamp DNA (Qiagen). Выделенную ДНК элюировали 50 мкл дистиллированной воды. Качество ДНК и концентрацию каждого образца измеряли электрофорезом в агарозном геле и Qubit 3.0 (Life Technologies, Waltham, MA) и до последующей обработки.
Высокопроизводительное секвенирование
Для каждого образца мы амплифицировали вариабельные области 3 и 4 (V3-V4) гена 16S рРНК с использованием модифицированных праймеров 341F и 805R. Очищенные положительные ампликоны с различными индексными последовательностями объединяли в эквимолярных количествах и затем секвенировали на платформе HiSeq2500 (Illumina, San Diego, CA) с реагентами v2 и картриджем 2 × 250 п.н. Метагеномная ДНК 50 образцов мекония (~ 0.5 мкг на образец) был разрезан на фрагменты размером ~ 300 п.н. с использованием сфокусированного ультразвукового устройства (Covaris, Woburn, MA). Библиотеки секвенирования были сконструированы из разрезанных фрагментов с использованием набора TruSeq Sample Preparation Kit v2 (Illumina). Длину вставки и целостность библиотек оценивали с помощью анализатора фрагментов (Advanced Analytical Technologies) перед секвенированием парных концов (PE) (2 × 125 п.н.) на платформе HiSeq2500.
Анализ последовательности 16S рРНК
Необработанные данные секвенирования последовательностей гена 16S рРНК были качественно отфильтрованы и проанализированы с использованием QIIME V.1.8.0.12 Оперативные таксономические единицы (OTU) были классифицированы таксономически с использованием эталонной базы данных гена 16S рРНК Greengenes.13 Таксономический состав микробных сообществ был визуализирован с помощью Calypso.14 Кластеризация сообществ была измерена с помощью невзвешенного расстояния UniFrac на основе нормализованной таблицы OTU. Вместе с набором данных микробиоты кожи новорожденных, полученным в результате недавнего исследования, с помощью пакета R ecodist было рассчитано различие Брея-Кертиса между различными типами образцов.Наборы микробных данных взрослого человека, включая 121 переднюю ноздрю, 312 слизистой оболочки рта, 73 образца влагалища, 102 слюны и 55 образцов стула, были загружены из проекта Human Microbiome Project (HMP). Кластерный анализ структуры бактериального сообщества проводился на уровне родов.
Дискриминантный анализ частичных наименьших квадратов и линейный дискриминантный анализ
Дискриминантный анализ частичных наименьших квадратов (PLS-DA) и линейный дискриминантный анализ (LDA) использовались для выявления таксономических и функциональных изменений в материнской и неонатальной микробиоте в ответ на GDM.16 17 PLS-DA был выполнен с использованием пакета R mixOmics (http://www.mixOmics.org). Дискриминационная способность каждого таксона оценивалась количественно с помощью переменной важности для параметров проекции (VIP). Оценки VIP использовались для ранжирования способности разных таксонов различать разные группы. Таксон с оценкой VIP> 1,0 считался важным для дискриминации. Категории KEGG с общей относительной численностью во всех пробах <1% были удалены. Величина эффекта была определена как значимая (p <0.05), различающиеся между группами, были оценены агентством LDA для выявления дискриминационной ортологии KEGG (KO) с использованием онлайн-приложения Galaxy (https://huttenhower.sph.harvard.edu/galaxy). Только функциональные категории с логарифмической оценкой LDA> 2,0 рассматривались как дифференциальные сигнатуры, которые лучше различают группы GDM + и GDM-.
Анализ соответствия и совместной встречаемости
Обогащение OTU было рассчитано для каждого типа образца путем сравнения как среднего, так и медианного относительного содержания между группами GDM + и GDM-.Для сетевого анализа совместной встречаемости бактериальные корреляции в материнских и неонатальных образцах с и без GDM были рассчитаны соответственно на основе относительной численности каждого рода с использованием SparCC со 100 бутстрапами для оценки значения p.18 Значения корреляции со значением p <0,05 были сохранены. Сети совместной встречаемости материнской микробиоты полости рта, кишечника и влагалища были визуализированы с помощью igraph (http://igraph.org). Близость и собственный вектор узлов были рассчитаны для измерения центральности узлов в каждой сети.Согласованность бактериальных корреляций между материнской и неонатальной микробиотой, связанной с GDM, была сделана путем подсчета одинаковых бактериальных корреляций в разных типах образцов и визуализирована с помощью OmicCircos19.
Реконструкция метаболического пути
KO-функциональное профилирование микробиоты мекония новорожденных было выполнено с использованием сборок, полученных на основе данных полногеномного секвенирования (WGS). Показания низкого качества сначала были вырезаны из необработанных данных секвенирования с помощью Trimmomatic.20 высококачественных считываний были собраны de novo в контиги с использованием metaSPAdes и metaSort с параметрами по умолчанию.21 22 Затем мы выполнили прогнозирование генов с помощью PROKKA V.1.11 для этих каркасов, 23 и предсказанные белки были назначены на KO с использованием Сервер автоматических аннотаций KEGG.24 Обрезанные высококачественные считывания, расположенные на заданных каркасах, были подсчитаны для расчета численности нокаутов в каждом образце с использованием выравнивателя Берроуза-Уиллера (BWA) 25. Матрицу нормализовали путем деления абсолютного количества каждого функционального гена. по общему количеству считываний, присвоенных функциональным генам в каждом образце.Анализ под наблюдением был проведен с использованием LDA для выявления функциональных путей микробов, которые по-разному экспрессировались в кишечной микробиоте новорожденных, родившихся женщинами с различным статусом уровня глюкозы.
Анализ вирома и подвидов
После удаления последовательностей ДНК человека были измерены таксономия и численность вируса и бактериофага в микробиоте неонатального мекония путем сопоставления показаний секвенирования WGS с пользовательской базой данных. Эта база данных была построена путем объединения геномных последовательностей вирусов и фагов из NCBI и PhAnToMe после удаления дубликатов, как описано в нашем предыдущем исследовании.26 считываний BLASTX для этой базы данных с порогом E -значение <10 -5 с использованием DIAMOND.27 Был вычислен наименьший общий предок всех таксонов в собранных совпадениях BLAST и использован для определения таксономического происхождения. Альфа-разнообразие вирусных и фаговых сообществ было рассчитано с использованием веганского (https://cran.r-project.org/web/packages/vegan). Для профилирования видов бактерий на уровне штаммов на основе данных метагеномного секвенирования геномы 35 Escherichia и 69 Lactobacillus , выделенных из полости рта, кишечника или влагалища человека, были получены из HMP и взяты в качестве эталонов.Считывания WGS каждого образца мекония были сопоставлены с этими эталонными геномами с помощью BWA.
Результаты
Мы набрали 140 новорожденных и 346 беременных женщин и взяли 1062 пробы, включая слюну, глоточный аспират, меконий и околоплодные воды новорожденных, а также слюну, фекалии и вагинальные выделения беременных женщин (онлайн-дополнительная таблица S1) . Подавляющее большинство неонатальных образцов, особенно амниотической жидкости, было собрано при кесаревом сечении (76 кесарева сечения против 17 вагинальных родов), чтобы избежать возможного заражения влагалищной флорой.Для каждого образца были секвенированы области 16S рРНК V3-V4, и 233 образца не смогли получить данные и были удалены из следующих анализов.
Секвенирование гена 16S рРНК подходящих 248 неонатальных (64 амниотической жидкости, 20 оральных, 81 глоточных и 83 мекониевых) и 581 материнских (175 оральных, 147 кишечных и 259 вагинальных) образцов дало 309 миллионов считываний PE (2 × 250 п.н. ), с ~ 373 241 чтением на выборку. Каждая пара считываний PE была объединена в одну последовательность путем перекрытия. Совпадения составляли 25–75 п.н. для каждого образца (онлайн-дополнительный рисунок S1A), и более 80% считываний PE были успешно объединены в длинные последовательности в 94.3% выборок (дополнительный рисунок S1B онлайн). Кроме того, согласно оценке охвата и кривой разрежения Good (дополнительный рисунок S1C, D), количество последовательностей может хорошо отражать микробное разнообразие каждого сообщества. При выборе различных методов для классификации OTU было небольшое расхождение (онлайн-дополнительный рисунок S1E). Все неонатальные образцы и половина материнских образцов (n = 289), собранные во время родов, были использованы для изучения возможного микробного сдвига нескольких участков тела, страдающих от GDM (онлайн-дополнительная таблица S2).Оставшаяся половина материнских образцов (95 оральных, 98 кишечных и 99 вагинальных) использовалась в качестве наборов данных для валидации. Подмножество образцов мекония было выбрано случайным образом для метагеномного секвенирования, и 48 из 50 образцов (24 для GDM + и 24 для GDM-) были успешно секвенированы, что дало более 1,5 миллиарда считываний PE (2 × 125 п.н.).
Измененная материнская микробиота нескольких участков тела в GDM
Чтобы выяснить, может ли материнская микробиота быть обусловлена уровнями глюкозы, мы сначала исследовали микробный сдвиг беременных женщин, которым был поставлен диагноз GDM.Соотношения общих или уникальных OTU в образцах ротовой, кишечной и вагинальной ротовой полости матери оценивались, чтобы определить, оказывает ли GDM аналогичное влияние на разные участки тела. Мы обнаружили, что пациенты с GDM (GDM +) имели больше OTU как минимум в двух участках тела, чем беременные женщины без GDM (GDM-), при этом примерно 57,6% OTU появлялись только в одном участке тела GDM- по сравнению с 47,0% в GDM + ( рисунок 1А). Кроме того, мы рассчитали расстояния Брея-Кертиса с использованием нормализованной численности OTU. Расстояния между образцами любых двух участков тела были значительно меньше в GDM +, чем в GDM- (p <0.05, тест Манна-Уитни) (рис. 1В). Эти результаты показывают, что микробный сдвиг в материнской микробиоте различных участков тела может быть связан с ГСД во время беременности.
Рисунок 1Микробные вариации беременных женщин, страдающих гестационным сахарным диабетом (ГСД). (A) Доли общих операционных таксономических единиц (OTU) среди материнской микробиоты полости рта, кишечника и влагалища. Общая ОТЕ означает, что определенная ОТЕ была обнаружена в двух или трех участках тела. (B) Различия бактериального сообщества между любыми двумя участками тела в материнских образцах.Расстояния Брея-Кертиса были независимо рассчитаны для групп GDM + и GDM-. VS представляет собой против. Статистическая значимость определялась с помощью теста Манна-Уитни. (C – E) Относительное количество типов бактерий в микробиоте полости рта, кишечника и влагалища беременных женщин. (F – H) Бактериальные роды со значительными (критерий Манна-Уитни с поправкой на частоту ложных открытий (FDR); * p <0,1) различиями между группами GDM + и GDM-. Обилие рода в каждой выборке было нормализовано до 100 000 прочтений. (I – K) Корреляция между значимыми различиями между бактериями и значениями теста на толерантность к глюкозе (OGTT).Метки 0 час, 1 час и 2 часа под прямоугольными диаграммами представляют моменты времени тестирования OGTT. Пара прямоугольников указывает бактериальные соотношения, соответствующие уровням глюкозы в крови ниже (левое поле) или выше (правое поле) пороговых значений (5,1 в 0 час, 10,0 через 1 час и 8,5 через 2 часа во время OGTT). Существенная разница (критерий Манна-Уитни, p <0,05) обозначается символом красного цвета, а символ ns синим цветом обозначает несущественную разницу (критерий Манна-Уитни, p ≥ 0,05).
Чтобы дополнительно продемонстрировать эти вариации, соответствующие GDM в разных участках тела, мы сравнили численность бактерий между группами на уровне филума.Наибольшие изменения произошли в полости рта: больше протеобактерий (p <0,05, тест Манна-Уитни с коррекцией частоты ложных обнаружений (FDR) с использованием метода Бенджамини-Хохберга), но меньше Firmicutes (p <0,01), обнаруженных в GDM + (рисунок 1C ). Не было показано никаких явных различий ни в кишечной, ни в вагинальной микробиоте (рис. 1D, E). Затем был проведен PLS-DA для улучшения разрешения флоры GDM. От семи до девяти родов со значением VIP> 1 были обнаружены из трех участков тела (онлайн-дополнительный рисунок S2A – F).Для проверки микробных вариаций, соответствующих GDM, были использованы 95 образцов перорального, 98 кишечных и 99 вагинальных образцов, взятых у второй когорты беременных женщин. Около 77,8% (7 из 9), 88,9% (8 из 9) и 71,4% (5 из 7) родов VIP, идентифицированных в наборах данных первой партии, можно было проверить во второй партии, и большинство из них показало последовательное обогащение или истощение в двух когортах (рисунок 1F – H и онлайн-дополнительный рисунок S2G – I). Для дальнейшего изучения взаимосвязи между этими родами и GDM мы связали их численность с результатами OGTT.Пороговые значения (5,1 в 0 час, 10,0 через 1 час и 8,5 через 2 часа во время OGTT) основаны на диагностических критериях, рекомендованных Международной ассоциацией групп по изучению диабета и беременности в 2011 году. Как показано на рисунке 1I – K, относительная численность этих бактерий сильно коррелировала со значениями OGTT (p <0,05, тест Манна-Уитни).
Микробиота новорожденных, матери которых страдали от ГСД, значительно отличается от таковой в контрольной группе
Чтобы изучить возможные эффекты ГСД на микробиоту новорожденных, мы затем исследовали состав сообщества и структуру новорожденных.В основном координатном анализе (PCoA) невзвешенных расстояний UniFrac образцы были сгруппированы в основном по участкам тела, с отдельными материнскими оральными, кишечными и вагинальными кластерами, а также кластерами неонатальной глотки, мекония и околоплодных вод (рисунок 2A). Узловая кластеризация тела наблюдалась в неонатальных образцах из разных участков тела, хотя разделение было не таким заметным, как у матери. Кроме того, мы рассчитали расстояние Брея-Кертиса внутри или между участками тела, чтобы количественно оценить сходство сообщества одного и того же типа образца.Расстояния между сообществами в образцах, полученных из одного и того же участка тела, как и ожидалось, были меньше, чем между разными участками тела (рис. 2В), что дополнительно подтвердило результаты кластеризации с помощью PCoA. Мы рассчитали расстояния Брея-Кертиса между неонатальной и материнской выборками. В результате, за исключением нескольких необычных выборок новорожденных, рожденных естественным путем, которые, очевидно, происходили из вагинального сообщества матери, способ родоразрешения оказал лишь очень незначительное влияние на микробиоту новорожденных (рис. 2С).Более того, неонатальная микробиота показала более высокое альфа-разнообразие, чем микробиота влагалища (рисунок 2D). Видовое богатство образцов глотки и околоплодных вод было даже сопоставимо с материнскими оральными и кишечными сообществами, микробное разнообразие которых было довольно высоким (дополнительный рисунок S3 онлайн). Микробиота новорожденных каждого участка тела имела уникальную структуру сообщества (рис. 2E). Напротив, материнские сообщества этих трех участков тела показали типичную структуру микробиоты взрослого человека (дополнительный рисунок S4 онлайн).
Рисунок 2Колонизация и специфичность участка тела неонатальной микробиоты при рождении. (A) Анализ основных координат (PCoA) невзвешенных расстояний UniFrac для образцов ротовой полости, кишечника и влагалища матери, а также амниотической жидкости новорожденных, образцов ротовой полости, глотки и мекония. Эллипсы представляют 95% доверительный интервал. (B) Различия бактериального сообщества внутри и между участками тела. Метки Phar, Inte, Amni и Vagi обозначают микробиоту глотки, кишечника, околоплодных вод и влагалища соответственно.Приведено среднее расстояние Брея-Кертиса для каждой группы парных сравнений. Красные и синие тени обозначают наименьшее и наибольшее значения в каждом столбце соответственно. (C) Влияние способов доставки на неонатальные бактериальные сообщества. Три края треугольника представляют материнскую микробиоту ротовой полости (коричневый), кишечника (желтый) и влагалища (зеленый). Каждая полая точка представляет собой неонатальный образец, а расстояние по вертикали до трех краев треугольника указывает среднее расстояние Брея-Кертиса между этим образцом и материнскими образцами.Точки ближе к краям означают, что такие неонатальные образцы более похожи по бактериальному сообществу на указанную материнскую микробиоту. (D) Альфа-разнообразие неонатальной и материнской микробиоты. Скрипка с прямоугольной диаграммой показывает медианное значение и IQR индексов разнообразия типа сэмпла, а ширина скрипки представляет собой распределение плотности индексов. (E) Таксономическое профилирование микробиоты глотки, кишечника и околоплодных вод новорожденных. Средняя относительная численность каждой таксономической категории представлена толщиной ветви.Каждый узел филогенетического дерева представляет один таксон микробов.
Учитывая, что неонатальная микробиота могла быть установлена при рождении, мы задались вопросом, будет ли такое микробное сообщество формироваться состоянием здоровья беременных женщин во время беременности. Соответственно, расстояния Брея-Кертиса были рассчитаны с использованием количества OTU микробиома из образцов околоплодных вод, глотки и мекония для оценки воздействия GDM на микробиоту новорожденных. Мы обнаружили, что расстояния между тремя типами выборок в GDM + были значительно меньше, чем в GDM- (p <0.001, тест Манна-Уитни) (рис. 3A), из которого следует, что GDM может влиять на микробиоту новорожденных и, следовательно, приводить к однородности сообщества по множеству типов образцов. Эта тенденция к изменению расстояния между сообществами соответствовала той, которая наблюдалась в ротовой, кишечной и вагинальной микробиоте матери (рисунок 1B). PCoA продемонстрировал минимальные различия между состоянием здоровья и болезнью околоплодных вод (Adonis p <0,001, R 2 = 0,069), глоточный (Adonis p <0.001, R 2 = 0,050) и мекония (Адонис p <0,05, R 2 = 0,026) микробиота (рисунок 3B – D). Образцы были сгруппированы преимущественно по ассоциациям GDM + и GDM-. Эти результаты показывают, что микробный состав и различия как у матери, так и у новорожденного могут быть обусловлены состоянием здоровья беременной женщины. Воздействие ГСД на микробы во время беременности может вертикально передаваться ребенку во время беременности.
Рисунок 3Микробиота новорожденных, связанная с гестационным сахарным диабетом (ГСД).(A) Бактериальные различия между микробиотой новорожденных. Расстояния Брея-Кертиса были рассчитаны для образцов GDM + и GDM- независимо. Статистическая значимость определялась с помощью теста Манна-Уитни. (B – D) Анализ основных координат (PCoA) невзвешенных расстояний UniFrac для околоплодных вод, глоточной и мекониевой микробиоты. Эллипсы представляют 95% доверительный интервал. (E – G) Наиболее многочисленные роды со значительным различием между группами GDM + и GDM−. Обилие рода в каждой выборке было нормализовано до 100 000 прочтений.Тест Манна-Уитни с поправкой на частоту ложных открытий (FDR): нет. * р <0,1; * р <0,05; ** р <0,01; *** р <0,001. Пара таксонов была выделена темным цветом, поскольку их относительная численность была наибольшей среди значительно обогащенных и истощенных родов GDM + в каждом типе образцов. (H – J) Корреляция между существенно различающимися бактериями микробиоты новорожденных и значениями перорального теста на толерантность к глюкозе (OGTT). Метки 0 час, 1 час и 2 часа представляют три момента времени тестирования OGTT.Пара прямоугольников показывает бактериальные соотношения, соответствующие уровням глюкозы в крови ниже (левое поле) или выше (правое поле) пороговых значений (5,1 в 0 час, 10,0 через 1 час и 8,5 через 2 часа во время OGTT). Тест Манна-Уитни; * р <0,05; ** р <0,01; *** p <0,001; нс p≥0,05.
Обилие бактерий между группами GDM + и GDM- было дополнительно сравнено на уровне рода, чтобы прояснить локально-специфические вариации тела, связанные с GDM в микробиоте новорожденных. Как показано на рис. 3E – G, образцы околоплодных вод имели больше родов со значительными межгрупповыми различиями, чем образцы глотки или мекония (p <0.1, тест Манна-Уитни с поправкой на FDR) в 30 самых распространенных родах, что указывает на большую микробную дифференциацию в околоплодных водах (рис. 3B – D). Чтобы изучить корреляцию между дискриминирующими бактериями и GDM, мы выбрали наиболее распространенные обогащенные или истощенные роды и рассчитали корреляцию их численности с соответствующими материнскими значениями OGTT. В результате сильная корреляция наблюдалась в нескольких группах (рисунок 3H – J и дополнительный рисунок S5 в Интернете). Мы также выполнили анализ PLS-DA в неонатальных образцах, чтобы определить дифференциальные сигнатуры между группами здоровья и заболевания (дополнительный рисунок S6 онлайн).Роды VIP, такие как Prevotella , Streptococcus , Bacteroides и Lactobacillus , преобладали в нескольких типах образцов материнской и неонатальной микробиоты, что отражает их возможное значение для ответа GDM на разных поколениях и участках тела.
Соответствие микробных вариаций между матерями и новорожденными, страдающими GDM
Учитывая, что как материнский, так и неонатальный микробиомы нескольких участков тела были заметно изменены с GDM, мы попытались изучить соответствие микробных вариаций между матерями и новорожденными.Сначала мы подсчитали количество OTU, обогащенных или истощенных у новорожденных с GDM, а затем сосредоточились на тех, которые были общими в материнских выборках. OTU, которая была обогащена (или истощена) материнской и неонатальной микробиотой GDM +, была определена как изменяющаяся по одной и той же тенденции. Напротив, OTU, которая была обогащена микробиотой новорожденных, но обеднена материнской микробиотой GDM +, была определена как противоположная тенденция, и наоборот. Соответственно, были подсчитаны таксономия и количество OTU, изменяющихся по одной и той же тенденции в материнской и неонатальной микробиоте, и было обнаружено, что большое количество OTU с высоким содержанием варьирует с той же тенденцией.Наиболее заметное соответствие микробной изменчивости было показано между амниотической жидкостью и материнской микробиотой полости рта (рисунок 4A, B и дополнительный рисунок S7 в Интернете), в котором большинство наиболее распространенных OTU варьировались с одной и той же тенденцией. Кроме того, было обнаружено, что около 100 OTU различаются с одинаковой тенденцией в одной материнской и трех неонатальных типах выборок. Prevotella , Streptococcus и Bacteroides были наиболее распространенными таксонами, показывающими соответствие микробных вариаций между матерями и новорожденными (дополнительные рисунки в Интернете S8 – S11).Вместе с Lactobacillus и Faecalibacterium (рисунок 4C – E) эти бактерии соответствовали общим родам VIP для материнских и неонатальных типов образцов (онлайн-дополнительные рисунки S2 и S6), что также отражает их важность для ответа на GDM. Эти наблюдения доказали, что, несмотря на локальные вариации в организме, GDM может иметь сходные эффекты как на материнскую, так и на неонатальную микробиоту.
Рисунок 4Сходные микробные сдвиги между материнской и неонатальной микробиотой, связанные с гестационным сахарным диабетом (GDM).Обилие операционных таксономических единиц (OTU) в каждой выборке было нормализовано до 100 000 считываний. (A) Соответствие вариаций OTU между околоплодными водами и микробиотой полости рта матери. Средняя относительная численность 100 самых распространенных OTU сравнивалась между группами GDM + и GDM-. Сплошные точки представляют собой OTU микробиоты околоплодных вод, а полые точки представляют микробиоту полости рта матери. Красные точки обозначают OTU, изменяющиеся по одной и той же тенденции, а синие точки обозначают противоположную тенденцию. (B) Совокупное количество OTU, изменяющихся в соответствии с одной или противоположной тенденцией.p <0,001, t-тест. (C – E) Наиболее распространенные таксоны, показывающие соответствие микробной изменчивости между матерями и новорожденными. Каждая цветная полоса указывает частоту OTU определенного рода. Полоса красного цвета представляет переменную важность для проекционного (VIP) рода, связанного с GDM, который является общим для материнских и неонатальных типов выборок.
Чтобы исследовать соответствие микробной совместимости между матерями и новорожденными, мы затем вычислили корреляции между бактериальными родами в материнских и неонатальных образцах с и без GDM.Приблизительно 47–62 родов (узлов) и 60–134 соединений (ребер) сохранялись при различных пороговых значениях корреляции (0,4–0,5) (онлайн-дополнительный рисунок S12A, B) в сетях совместной встречаемости материнских оральных, кишечных и микробиота влагалища. При сравнении сетей GDM + с сетями GDM− их компоненты и топографии были довольно различны, и наиболее заметное различие происходит из-за связей родов VIP с другими бактериями (рис. 5A – C). Чтобы количественно оценить такую разницу, мы подсчитали количество ребер и центральность узлов в материнских микробных сетях с различным статусом GDM.Несмотря на наличие нескольких перекрывающихся ребер, десятки ребер были специфичными для GDM + или GDM- (рисунок 5D), а близость и собственный вектор общих узлов между GDM + и GDM- также сильно различались (рисунок 5E и дополнительный рисунок S12C онлайн). Более того, внутригрупповые различия всегда были очевидны в каждом интервале значений корреляции (онлайн-дополнительный рисунок S12D – F). Что касается новорожденных, бактериальные корреляции также были различны между GDM + и GDM- (рисунок 5F, G и дополнительный рисунок S12G онлайн).Например, в микробиоте глотки около 69,2% корреляций со значением корреляции> 0,4 существовали только в GDM +, в то время как ~ 18,7% присутствовали только в GDM- (рисунок 5F). Аналогичные результаты наблюдались и для мекония: 76,9% и 15,3% уникальных корреляций присутствовали в GDM + и GDM-, соответственно (рисунок 5G). Примечательно, что бактериальные корреляции между образцами матери и новорожденного, ассоциированными с GDM, были в высокой степени сохранены (рисунок 5H и дополнительный рисунок S12H в Интернете). Около 88,8% всех бактериальных связей имели одинаковую тенденцию к совместному возникновению между поколениями, а 69.1% были обнаружены только в GDM +, но не в GDM-. Среди них положительная корреляция между Neisseria и Haemophilus и отрицательная корреляция между Lactobacillus и несколькими VIP-бактериями (включая Porphyromonas и Bacteroides ) присутствовали почти на всех участках тела матери и новорожденного (дополнительный рисунок S12I в Интернете). ). Кроме того, соединения, содержащие Blautia , Coprococcus , Roseburia и Sutterella , показали высокую частоту совместного присутствия в нескольких типах образцов, что позволяет предположить их универсальную принадлежность к микробиоте, связанной с GDM.Согласно этим результатам, можно предположить, что постоянство микробной изменчивости у матерей и новорожденных, страдающих от GDM, произошло в изобилии бактерий и в их взаимодействиях.
Рис. 5Сеть сочетания бактерий и соответствие между материнской и неонатальной микробиотой, связанной с гестационным сахарным диабетом (GDM). (A – C) Сети совместного присутствия материнской микробиоты полости рта, кишечника и влагалища GDM + (левая панель) и GDM- (правая панель). Сеть совместной встречаемости была выведена для каждого типа материнской выборки путем парной корреляции относительной численности (нормированной на 100 000) для всех родов.Каждый узел в сети указывает на род бактерий. Размер узла представляет собой среднюю относительную численность одного рода в каждом типе материнской выборки. Узлы зеленого цвета показывают переменную важность для родов проекций (VIP), связанных с GDM. Сохраняются только бактериальные связи (края), превышающие пороговые значения (значения корреляции> 0,4, 0,45 и 0,5 в трех сетях соответственно). Ширина края представляет собой значение корреляции, поддерживающее это соединение. Цвет краев показывает положительную (красный) и отрицательную (синий) корреляцию соответственно.(D, E) Расхождения в бактериальных сетях совместного возникновения между материнским GDM + и GDM-. Подсчитывалось количество уникальных и общих ребер, а также центральности (ранг близости) и расхождения узлов в сетях совместного появления GDM + и GDM-, соответственно. (F – G) Расхождения в бактериальных корреляциях между неонатальной микробиотой GDM + и GDM-. Каждая ячейка показывает количество одинаковых пар бактериальных корреляций, имевших место как в GDM +, так и в GDM-, с изменениями цвета, представляющими слабую (серый) или сильную (синий и красный) корреляции, соответственно.(H) Соответствие бактериальных корреляций между материнской и неонатальной микробиотой, связанной с GDM. Соответствие было выведено путем подсчета одинаковых бактериальных корреляций (пороговое значение> 0,4) для разных типов образцов. Каждая точка внешнего цикла представляет собой одно соединение двух коррелированных бактерий (по крайней мере, одна принадлежит к роду VIP). Кривая красного цвета (встречается только в GDM +) и серого (встречается как в GDM +, так и в GDM-) обозначает одну и ту же тенденцию совместного возникновения такой связи между материнской и неонатальной микробиотой, а кривая синего цвета обозначает противоположную тенденцию.
Измененный микробный метаболизм и повышенная вирусная нагрузка в GDM + меконий
Микробиота кишечника новорожденных важна для метаболизма и иммунитета развивающихся младенцев и взрослых.28–30 Поэтому мы попытались оценить потенциальные риски микробного перехода новорожденных, профилируя микробиота мекония, и, таким образом, для секвенирования WGS была выбрана подгруппа проб мекония. Было успешно секвенировано 48 образцов, что дало более 375 Гб данных секвенирования WGS.Метагеномное таксономическое профилирование данных секвенирования WGS образцов мекония было выполнено с использованием MetaPhlAn.31 По сравнению с таксономическими профилями мекония на основе 16S рРНК, метагеномное секвенирование генерирует довольно похожую структуру бактериального сообщества (дополнительный рисунок S13 онлайн). Мы искали метаболические различия между кишечной микробиотой новорожденных, рожденных женщинами с ГСД и без. В результате меньшие индексы Pielou для КО были показаны в группе GDM + (рис. 6A), что означает, что микробиота новорожденных в этой группе имела более низкую равномерность, чем в группе GDM-.LDA использовалась для выявления межгрупповых различий в KO, и большое количество KO было истощено в GDM +, что указывает на снижение метаболических возможностей по сравнению с микробиотой кишечника новорожденных, рожденных женщинами без GDM (рисунок 6B и дополнительная онлайн-таблица S3). Отсутствие таких метаболических путей может отрицательно влиять на усвоение пищи или определенную метаболическую способность новорожденных.
Рисунок 6Микробные и функциональные изменения микробиоты мекония, связанные с гестационным сахарным диабетом (ГСД).(A) Равномерность ортологии KEGG (KO). (B) Количество обогащенных КО. (C, D) Распределение вирусного богатства и равномерности. (E, F) Относительная численность вируса герпеса и поксвируса. Обилие вирусов в каждом образце было нормализовано до 100 000 считываний. (G, H) Распространенность мастаденовируса и папилломавируса в меконии. (I, J) Значительная дифференциация штаммов Escherichia и Lactobacillus между GDM + и GDM-. Геномы штаммов Escherichia и Lactobacillus , выделенных из ротовой полости, кишечника или влагалища человека, были загружены из Human Microbiome Project (HMP) и взяты в качестве ссылок.Считывания секвенирования были сопоставлены с этими ссылками, а численность штаммов в каждом образце была нормализована до 100 000 считываний.
Мы также сравнили данные WGS с известными вирусными геномами, чтобы выявить возможные изменения в вироме мекония. Хотя более высокое богатство (количество наблюдаемых видов вирусов) эукариотических вирусов в меконии GDM + было незначительным (рисунок 6C), как вирусная однородность (индекс Пиелу в каждом образце), так и индексы альфа-разнообразия были значительно ниже, чем у GDM- ( р <0.05, тест Манна-Уитни) (рисунок 6D и онлайн-дополнительный рисунок S14A – D). Напротив, не было очевидных межгрупповых различий в альфа-разнообразии бактериофагов (онлайн-рисунок S14E – H). Дальнейшее исследование оценило относительное количество распознаваемых вирусных таксонов и выявило четыре типа вирусов, которые варьировались в зависимости от состояния здоровья беременных женщин, включая герпесвирус, поксвирус, мастаденовирус и папилломавирус. Среди них герпесвирус и поксвирус были более распространены в группе GDM + (рис. 6E, F), а также более распространены мастаденовирус и папилломавирус в образцах этой группы (рис. 6G, H).Эти данные свидетельствуют о том, что беременные женщины, страдающие ГСД, увеличивают распространенность вирусов в кишечной микробиоте новорожденных и могут привести к появлению населения, очень уязвимого к воздействию этих вирусов.
Наконец, чтобы исследовать внутривидовое разнообразие некоторых неонатальных кишечных бактерий, мы сопоставили данные WGS-секвенирования образцов мекония с доступными в настоящее время эталонными геномами Escherichia и Lactobacillus , которые включают геномы 35 Escherichia и 69 Lactobacillus , выделенных. из полости рта, кишечника и влагалища человека, извлеченных из HMP (рис. 6I, J).Учитывались только однозначно картированные чтения этих геномов. Большое количество считываний может быть отнесено к геномам эталонных штаммов, выделенных не только из влагалища, но и из ротовой полости и кишечника человека, что дополнительно подтвердило наблюдение о том, что неонатальная микробиота происходит не только из влагалища. Кроме того, мы наблюдали, что как Escherichia , так и Lactobacillus показали различия в уровне штаммов между новорожденными, родившимися от матерей с GDM и без него. Примечательно, что Lactobacillus iners штаммов были значительно более многочисленны в GDM + (p <0.05, тест Манна-Уитни с поправкой FDR) (рисунок 6J). Эти данные продемонстрировали, что Lactobacillus spp и их подвиды у новорожденных могут быть сформированы статусом GDM их матерей.
Обсуждение
Большинство неонатальных образцов в нашем исследовании были собраны в течение нескольких секунд после доставки кесарева сечения, что позволило нам исключить возможность микробного воздействия и колонизации in vitro . Микробы, присутствующие в этих образцах, указывают на формирование микробиоты плода, в отличие от обнаружения микробов в меконии, которое, как сомневается, было результатом послеродового приобретения.11 Секвенирование гена 16S рРНК выявило бактериальные сигналы от каждого участка тела новорожденного, а некоторые участки тела (например, микробиота глотки и околоплодных вод) даже имеют относительно высокое видовое богатство. В сочетании с заметной разницей в таксономическом составе и структуре сообществ неонатальной и материнской микробиоты эти результаты показывают, что не все микробные нуклеиновые кислоты, обнаруженные в амниотической жидкости и образцах новорожденных, являются контаминантами от матери, как предполагалось ранее.32 Кроме того, как показано в анализе несходства PCoA и Брея-Кертиса, очень ясно, что неонатальные образцы были сгруппированы в соответствии с типами образцов. Наблюдаемой кластеризации различных типов образцов не наблюдалось бы, если бы их микробы возникли в результате потенциального материнского заражения или загрязнения реагентами. Более того, живые бактерии были успешно культивированы из околоплодных вод беременных женщин как с GDM +, так и с GDM- (данные не показаны). Несмотря на то, что в одном обзоре использовались мыши без микробов в качестве примера, чтобы отвергнуть гипотезу микробной колонизации в утробе матери, 11 мы предполагаем, что причиной могут быть различия в клеточных структурах плаценты и продолжительности беременности между мышами и людьми.Два слоя синцитиотрофобластов и один полный слой цитотрофобластов в плаценте мыши создают сильные барьеры для предотвращения вертикальной передачи микробов от матери к потомству 33, а короткая продолжительность беременности (19–21 день) также снижает вероятность попадания бактерий в матку мыши. Напротив, у людей в плаценте есть только один слой синцитиотрофобластов, и более длительная беременность дает бактериям больше шансов проникнуть в матку. Таксономическое профилирование как 16S рРНК, так и метагеномное секвенирование показали, что Enterobacteriaceae и Escherichia являются наиболее распространенными таксонами в образцах мекония.Это согласуется с предыдущими исследованиями микробиоты плаценты34 или мекония15. Эти результаты позволяют предположить, что Escherichia преобладает в утробе матери и в молодом возрасте.
В сочетании с результатами предыдущих исследований 10 35 мы считаем, что GDM может влиять на микробиоту как беременных женщин, так и новорожденных во многих частях тела во время беременности. Хотя OGTT был принят в качестве золотого стандарта для диагностики GDM, для мониторинга необходим анализ крови, и его проводят только между 24 и 28 неделями во время беременности.6 Существует сильная корреляция между несколькими дискриминационными бактериями и значениями OGTT. Например, в материнской микробиоте, оральные соотношения Neisseria / Leptotrichia положительно коррелировали со значениями глюкозы в крови, особенно с концентрациями глюкозы в крови натощак, которые отражают суточную секреторную способность базального инсулина. Низкое кишечное соотношение Faecalibacterium / Fusobacterium соответствовало высоким значениям глюкозы в крови, где корреляция была очень значимой между соотношением бактерий и 2-часовыми уровнями глюкозы в крови, что отражает способность к регуляции и восстановлению после приема сахара.Кроме того, высокие показатели вагинального соотношения Prevotella / Aerococcus также коррелировали с высокими значениями глюкозы в крови, особенно с 1- и 2-часовыми значениями OGTT. Хотя образцы матери, собранные до OGTT, необходимы, это может обеспечить многообещающий подход к разработке биомаркеров GDM, особенно для микробов полости рта, которые очень удобны для отбора образцов и имеют самые большие микробные вариации, связанные с GDM.
Как в материнской, так и в неонатальной микробиоте, микробные вариации имели тенденцию сходиться по участкам тела в GDM +, которые имели более сходную структуру сообщества, чем в GDM-.Микробы, различающиеся по одной и той же тенденции между материнской и неонатальной микробиотой, также наблюдались в нашем исследовании, что выявило межпоколенческую согласованность микробных вариаций, связанных с GDM. Эти результаты предполагают, что GDM может оказывать одинаковое влияние на микробиоту в разных поколениях и на разных участках тела. Такие микробные изменения, вероятно, увеличивают риск гестационных осложнений или нежелательных исходов. Более низкая равномерность, но большее истощение КО, а также более высокая численность или распространенность некоторых эукариотических вирусов могут привести к снижению метаболических возможностей и большему воздействию вирусов на новорожденных с ГСД, чем без него.Кроме того, L. iners считается более способствующим возникновению аномальной микробиоты, которая может привести к неблагоприятным последствиям для здоровья.36 37 L. iners имеет самый маленький размер генома среди лактобацилл и не имеет генов, необходимых для синтеза аминокислоты de novo ,38 Относительно высокое соотношение этого штамма может снизить эффективность метаболизма микробных аминокислот в пищеварительном тракте новорожденных.
Здесь мы описываем влияние состояния здоровья матери на вертикальную передачу микробов и колонизацию в раннем возрасте.Связь между микробным дисбиозом в раннем периоде жизни и большим количеством заболеваний может указывать на долгосрочное влияние исходной микробиоты на здоровье человека39–41. Наше исследование сосредоточено на контакте с микробами и их колонизации в раннем возрасте, а также на форме микробов. неонатальный микробиом. Эти наблюдения будут способствовать лучшему пониманию происхождения микробиоты человека и вертикальной передачи микробов от матери к младенцу. Это исследование проливает свет на другую форму наследования и подчеркивает важность понимания формирования микробиома в раннем возрасте, что предлагает многообещающий подход к модуляции начальной микробной колонизации и взаимодействия посредством вмешательства матери для снижения риска неблагоприятных последствий для здоровья.
Как здоровый микробиом кишечника защищает вашу беременность и — Just Thrive
Микробиом кишечника, триллионы бактерий, обитающих в кишечнике, могут повлиять на исход вашей беременности и даже на здоровье вашего ребенка на протяжении всей жизни.
Новое исследование показало, что кишечные бактерии мамы играют ключевую роль в трех основных рисках беременности:
- Инфекция Strep B
- Преэклампсия
- Преждевременные роды
Ученые разрабатывают и проводят исследования прямо сейчас, чтобы узнать, как эффективное изменение баланса микробиома матери может помочь избежать плохих результатов … принести пользу микробиому кишечника ребенка … и улучшить иммунную систему ребенка и его сопротивляемость инфекциям после его рождения.
Это относительно новое направление исследований, но результаты ясно показывают…
Здоровый микробиом кишечника матери помогает обеспечить здоровые роды и рождение ребенка. И лучший способ добиться этого — использовать целевые пробиотики.
Поддержание здорового баланса кишечника защищает вашего ребенка
Микробиом кишечника во время беременности претерпевает резкие изменения, и это должно происходить. Без этих изменений ваше тело не смогло бы принимать, кормить и выкармливать ребенка.
Но некоторые сбои могут вызвать состояние, называемое дисбактериозом, когда количество вредных бактерий (патогенов) превышает количество полезных бактерий (пробиотиков). А дисбактериоз может увеличить риск проблем во время беременности.
К счастью, вы можете исправить дисбактериоз, сбалансировав микробиом кишечника с помощью пробиотиков. Исследователи считают, что прием пробиотиков во время беременности может снизить риск «неблагоприятных исходов» для вас и вашего ребенка.
Пробиотики подавляют Strep B
Практически у каждого человека время от времени в организме появляются бактерии Strep B (также известные как Streptococcus группы B или GBS) — и обычно это не приносит никакого вреда.
Но проблемы могут возникнуть, когда у беременных женщин наблюдается чрезмерный рост этих бактерий, которые могут повлиять на здоровье их ребенка при рождении. Strep B может вызывать серьезные инфекции у новорожденных и нарушать микробиомы кишечника в младенчестве … и, возможно, на всю жизнь.
Большинство беременных женщин проходят тестирование на Strep B. При положительном результате им обычно вводят внутривенные антибиотики во время родов… но это может быть не лучшим вариантом для здоровья вашего ребенка на протяжении всей жизни.
Новое исследование показывает, что прием пробиотиков во время беременности может контролировать Strep B.Это потому, что пробиотики могут помочь защитить микробиом кишечника от чрезмерного роста патогенов.
В одном клиническом испытании исследователи давали пробиотики беременным женщинам с Strep B… и к концу испытания 68% этих женщин дали отрицательный результат на инфекцию.
Пробиотики защищают от преэклампсии
Преэклампсия, воспалительное состояние, может вызывать серьезные осложнения у беременных женщин и их детей. При ударе у матери может развиться опасно высокое кровяное давление и сильная опухоль, что создает огромный риск для беременности.
Новое исследование связывает преэклампсию непосредственно с дисбактериозом кишечника
Беременные женщины с преэклампсией имели сильно дисбаланс кишечных бактерий. Популяции болезнетворных бактерий были заоблачными. Полезные кишечные бактерии, включая особые штаммы, такие как Akkermansia , необходимые для хорошего здоровья, были сильно истощены.
Восстановление баланса микробиома кишечника матери — особенно на поздних сроках беременности — помогает снизить риск тяжелой преэклампсии на 20%.
Пробиотики могут предотвратить преждевременные роды
Различные факторы могут вызвать преждевременные роды, но наиболее частыми причинами являются высокий уровень воспаления и дисбактериоз влагалища (переизбыток вредных бактерий во влагалищном канале).Обе эти проблемы могут возникать из-за несбалансированного микробиома кишечника, что делает его идеальной целью лечения как для матери, так и для ребенка.
У женщин с дисбактериозом влагалища риск преждевременных родов вдвое выше. Исследователи только начали изучать, насколько хорошо пробиотики могут снизить этот риск, поэтому мы все еще узнаем больше каждый день. Что нам известно на данный момент:
- Стандартные методы лечения преждевременных родов могут вызвать проблемы с сердцем у матери и ребенка, с максимальной выгодой 72-часовой задержки
- Пробиотики могут восстановить здоровый баланс микробиома
- Пробиотики уменьшают воспаление и воспалительные соединения
- Пробиотики могут помочь снизить риск преждевременных родов
Ученые призывают к дальнейшим исследованиям по этой важной теме, и в ближайшее время появятся новые исследования.Между тем, годы исследований (и здравого смысла) говорят нам, что пробиотики помогают контролировать дисбактериоз влагалища и уменьшать воспаление во всем теле.
Здоровое начало для вашего ребенка
У ребенка, растущего внутри вас, есть собственный микробиом кишечника с бактериями, предоставленными вами.
Микробиом кишечника вашего ребенка определяет, насколько быстро он будет расти и насколько хорошо он сможет противостоять инфекциям после рождения. Это особенно важно для недоношенных детей.
Стимуляция микробиома кишечника матери может принести пользу иммунной системе ребенка. Если начать с более здорового микробиома кишечника, это может привести к лучшим результатам для здоровья на всю жизнь, например, к снижению риска аллергии и аутоиммунных состояний.
Подарите своему ребенку здоровый микробиом кишечника
Поддержание здорового баланса кишечного микробиома с помощью пробиотиков со спорами Just Thrive обеспечивает более здоровое начало для вашего ребенка.
Четыре клинически протестированных штамма спор пробиотиков в Just Thrive быстро вытесняют патогенные бактерии и позволяют полезным бактериям процветать, обеспечивая сбалансированный микробиом кишечника.
Поддержите микробиом кишечника и ребенка, добавив Just Thrive Probiotic в свой распорядок дня сегодня.
Что я могу сделать, чтобы улучшить микробиом кишечника во время беременности?
Старший эмбриолог, тренер по фертильности, личный тренер, учитель йоги, диетолог и автор
Последние сообщения Наташи Данн (посмотреть все)Беременность вызывает множество изменений в вашем организме, таких как гормональные колебания, выработка молока, увеличение объема крови, и иммунологические, метаболические и микробные изменения микробиома кишечника.Эти изменения необходимы вашему телу, чтобы создать идеальную среду, которую вы можете предложить своему ребенку на следующие десять месяцев.
Что такое микробиом кишечника?
Внутри нашего живота находится партия из миллиардов живых хороших и плохих бактерий. Ваш ребенок во время беременности — не единственный живой организм внутри вас, и его не было уже очень давно!
Эта группа бактерий в кишечнике известна как ваш микробиом, и эти маленькие ребята также связаны с правильным функционированием вашей иммунной системы.
Ваш кишечник всегда состоит из хороших и плохих бактерий, но обычно хорошие бактерии перевешивают плохие, контролируя здоровье кишечника и работая с иммунной системой, чтобы поддерживать хорошее здоровье вашего тела.
Какие изменения происходят в моем кишечном микробиоме во время беременности?Во время беременности кишечник остается относительно неизменным до третьего триместра, когда кишечник претерпевает резкие изменения. К третьему триместру микробиота (полезные бактерии) в кишечнике меняется на дисбактериоз (хорошие бактерии выходят из равновесия).
Исследование, проведенное Кореном, O et all , (2012), показало, что во время беременности кишечник стал воспалительным, что вызывает микробный дисбактериоз и увеличение веса из-за метаболического синдрома. Если бы вы не были беременны, это было бы ненормально, хотя во время беременности это необходимо для роста плода.
Вы можете обнаружить, что не только микробиом кишечника меняется, как и микробиом влагалища. Все большее количество вагинальных бактерий начинает готовиться к созданию собственного микробиома вашего ребенка, когда они появляются в мире.
Эти изменения во время беременности не вызывают беспокойства, поскольку на данном этапе они совершенно нормальны, и после родов кишечник вернется в состояние, которое было до беременности.
Микробиом кишечника и прибавка в весе во время беременностиНа прибавку в весе матери во время беременности влияет ее микробиота. Здоровый кишечник до беременности может помочь снизить риск избыточного веса или ожирения во время беременности.
Collardo, M, C, и др. (2008), показали разницу в микробиоте кишечника у женщин с избыточным и нормальным весом, показывая, что с каждым килограммом увеличения веса количество вредных бактерий увеличивается.Это не представляет опасности для беременных, так как после беременности кишечник придет в норму.
Что я могу сделать, чтобы улучшить здоровье кишечника во время беременности?Убедитесь, что вы получаете достаточно следующего:
- B-комплекс витаминов (B-6 и B-12)
- Кальций
- Магний
- Бета-каротин
- цинк
- Темно-зеленые листовые овощи, например шпинат и капуста
- Рыба, такая как лосось и скумбрия
- Свежее мясо
- Пребиотические продукты, такие как чеснок, лук-порей, лук, спаржа и бананы
- Квашеная капуста, кимчи, кефир, мисо и другие ферментированные продукты, которые вам нравятся
Избегайте следующего:
- Мясные полуфабрикаты
- Углеводы из кукурузы и хлеба
- Слишком много яблок и винограда
- Молочные продукты, кишечные бактерии сбраживают сахарный компонент молочной лактазы
- Продукты с высоким содержанием сахара
Пре- и пробиотики помогают поддерживать баланс кишечных бактерий, наряду с медитацией и йогой.Поговорите с одним из наших диетологов сегодня, чтобы выбрать лучший для вас пре и пробиотик.
Список литературыКолладо, М., К., Изолаури, Э., Лайтинен, К., Салминен, С. (2012). Отличный состав микробиоты кишечника во время беременности у женщин с избыточным и нормальным весом. Американский журнал клинического питания 88, 4, 894-899.
Корен, О., Гудрич, Дж., К., Каллендер, Т., К., Спор, А., Лайтинен, К., Бэкхед, Х., К., Гонсалес, А., Венер, Дж., Дж., Ангенент, Л., Т., Найт, Р., Бэкхед, Ф., Изолаури, Э., Салминен, С., Лей, Э, Р. (2012). Ремоделирование кишечного микробиома и метаболические изменения хозяина во время беременности. «Cell Press» 150, 3, 470-480.
СвязанныеПытаетесь зачать ребенка? Сосредоточьтесь на здоровье кишечника
Если вы сейчас пытаетесь забеременеть или думаете, что забеременеете в ближайшем будущем, вы, вероятно, уже задумались об улучшении своего питания.Хорошо известно, что правильное питание помогает вырастить здоровых детей (и предотвращает многие осложнения беременности). Вы слышали это от меня, вы слышали это от своего врача, и это имеет смысл, верно? Но вы можете не знать, что есть еще одна важная область, на которой нужно сосредоточиться до зачатия и во время беременности. Это то, над чем я работаю со всеми своими клиентами в моей практике, которые пытаются зачать…
Ваш микробиом — особенно здоровье кишечника.
Какое отношение имеет кишечник к беременности или рождению здорового ребенка? На самом деле, здоровье кишечника может сильно повлиять на вашу беременность. Позвольте мне объяснить, почему до того, как вы забеременеете, следует сосредоточиться на решении проблем со здоровьем пищеварения.
Начнем с основ. Микробиом — это в основном все бактерии, которые живут в вашем теле и внутри него. Только в пищеварительной системе их 100 триллионов. Количество бактериальных клеток на самом деле превышает количество собственных клеток нашего тела! На самом деле мы больше бактерий, чем людей.Большинство этих микробов прекрасны, они очень много делают для нашего здоровья. Но некоторые из них — нет. Тем не менее, микробиом влияет практически на все аспекты вашего общего состояния здоровья и обмена веществ. Они могут ударить:
— Здоровье пищеварительной системы: газы, вздутие живота, запор, диарея.
— Масса тела
— Уровни энергии
— Риск аутоиммунного заболевания
— Функция иммунной системы
— Воспаление или риск хронических заболеваний, таких как диабет 2 типа
— Способность поглощать питательные вещества из пищи
— Здоровье кожи
— Насколько хорошо вы справляетесь со стрессом
— Аллергия
Как видите, это большая ответственность для маленьких крошечных микробов! Здоровый и сбалансированный микробиом может помочь организму работать бесперебойно и снизить риск заболеваний.Проблема в том, что у многих из нас в микробиоме наблюдается дисбаланс хороших и плохих бактерий, который называется «дисбактериозом», и мы даже не подозреваем об этом. Большинство из нас просто думает, что если у нас нет проблем с пищеварением, все в порядке, но симптомы гораздо шире.
Дисбаланс влияет не только на ваше собственное здоровье, он может повлиять на исход беременности и здоровье вашего ребенка в долгосрочной перспективе. Хорошей новостью является то, что вы можете восстановить баланс и улучшить свой микробиом и общее состояние кишечника до беременности (и поддерживать баланс во время беременности) с помощью некоторых ключевых стратегий.Мы поговорим об этих стратегиях чуть позже, но давайте посмотрим на связь между микробиомом и здоровой беременностью.
Во время беременности ваша иммунная система изменяется, воспаление усиливается, и этот сдвиг влияет на ваш микробиом. Эстроген и прогестерон, два гормона, которые увеличиваются во время беременности, также могут изменять микробиом и влиять на здоровье кишечника. Если вы когда-либо были беременны раньше, возможно, вы испытали изменения в своем нормальном пищеварении, что является преднамеренным; пищеварение замедляется, поэтому вы можете извлечь больше питательных веществ из продуктов, которые вы едите.Но это изменение также частично связано с изменением микробиома (и гормонов).
В зависимости от того, что происходит с микробиомом во время беременности, то есть от того, каким бактериям разрешено проникать, это может увеличить риск определенных осложнений и повлиять на здоровье вашего ребенка.
Вот несколько осложнений беременности, которые связаны со здоровьем микробиома:
Риск преждевременных родов.
Преждевременные роды — это когда роды происходят до 37 недель.Это основная причина длительной инвалидности и смертности младенцев. Здоровье микробиома кишечника, влагалища и даже рта связано с повышенным риском преждевременных родов. Во влагалище здоровый микробиом предотвращает инфекции, которые могут привести к осложнениям беременности, включая стрептококк группы B, частую причину использования антибиотиков во время родов. Заболевание десен или избыток вредных бактерий во рту приводит к увеличению преждевременных родов в 2-7 раз. Да хоть твой рот! Кишечные бактерии были обнаружены в околоплодных водах преждевременных родов женщин, что означает, что они также могут иметь влияние.Здесь важно отметить, что все наши системы связаны между собой, и когда дисбаланс микробиома обнаруживается в одной части вашего тела, он обычно отражает дисбаланс всей системы.
Риск преэклампсии
Преэклампсия — это заболевание, которое возникает на поздних сроках беременности и приводит к опасному высокому кровяному давлению и выделению белка с мочой. Он поражает 10% беременностей и может вызвать серьезные осложнения для матери.Заболевание десен, на которое влияет баланс бактерий во рту, у матери связывают с повышенным риском преэклампсии.
Риск гестационного диабета
Гестационный диабет (ГСД), тип диабета, возникающий во время беременности, поражает 14% всех беременных женщин. Если не лечить, GDM может привести к серьезным осложнениям для ребенка и матери, слишком большому плоду и повышенному риску кесарева сечения. Было обнаружено, что у женщин, у которых развивается ГСД, меньше разнообразия и больше микробов, вызывающих воспаление, в микробиоме кишечника.
Увеличение веса во время беременности
Микробиом кишечника был связан с высоким весом до беременности и увеличением веса во время беременности. Исследования показали, что у людей с избыточным весом другой микробиом, с другими типами бактериальных штаммов и, как правило, меньшее разнообразие по сравнению с теми, у кого нет. Женщины с большим количеством штаммов Lactobacillus в кишечнике, как правило, не набирают такой большой вес во время беременности, как женщины, у которых их меньше.Здоровый набор веса во время беременности снижает риск диабета, преэклампсии и других осложнений беременности.
Здоровый микробиом может снизить риск многих осложнений, связанных с беременностью. Убедившись, что ваш микробиом здоров, как в кишечнике, так и во всем теле, вы можете увеличить свои шансы на здоровую беременность и роды.
Микробиом и здоровье младенцев
Младенцы получают 100% своего первоначального микробиома от матери.Раньше считалось, что младенцы рождаются со стерильным кишечником и не подвергаются воздействию микробов, пока не родятся. Но новые исследования показали, что на самом деле в плаценте и околоплодных водах есть целый уникальный микробиом. Тип бактерий, обнаруженных в матке и плаценте, больше всего похож на бактерии, обнаруженные во рту человека.
После рождения на колонизацию кишечника младенца влияют тип родов (вагинальные или кесарево сечение), генетика, гестационный возраст и размер ребенка.Было показано, что у недоношенных детей отсутствуют важные штаммы бактерий, а у крупных детей штаммы, как правило, отличаются от штаммов с нормальным весом. Тип и разнообразие штаммов при рождении могут иметь долгосрочное влияние на здоровье.
Микробиом продолжает развиваться даже после рождения. Грудное вскармливание или кормление смесью меняют микробиом младенца с возрастом. Раннее использование антибиотиков, например, при стрептококковой инфекции группы B, также может повлиять на здоровье микробиома в долгосрочной перспективе.То, как и когда вводятся твердые вещества, меняет микробиом. Существует множество различных факторов, влияющих на развитие здорового микробиома в первые годы жизни.
Итак, как микробиом влияет на здоровье вашего ребенка? Столько удивительных способов! Вот лишь несколько:
Меньше аллергии и экземы.
Уровень аллергии растет, и родителям может быть очень страшно с этим справиться. Но исследование, проведенное в 2013 году в педиатрии, показало, что пробиотики во время беременности снижают риск пищевой и экологической аллергии на 12%.Причина может заключаться в том, что здоровый микробиом и раннее воздействие бактерий могут способствовать укреплению иммунной системы. Он также может научить иммунную систему на раннем этапе правильно реагировать на окружающую среду, вместо того, чтобы чрезмерно реагировать на доброкачественные триггеры, как в случае аллергии.
Риск аутизма
Число диагнозов аутизма растет, поэтому в исследовательском мире есть большой интерес, чтобы попытаться выяснить причину.Кажется, есть связь между аутизмом, иммунной системой и микробиомом. Как все это работает вместе, до сих пор не совсем понятно. Недавнее исследование показало, что существует связь между пренатальным микробиомом матери и развитием поведенческих проблем, включая аутизм. В настоящее время необходимы дополнительные исследования, чтобы точно выяснить, как микробиом влияет на риск аутизма.
Усиление иммунной функции
Хорошо колонизированный микробиом с разнообразием видов, как правило, также укрепляет иммунную систему.Младенцы, рожденные естественным путем и у которых после рождения наблюдается контакт кожа к коже, как правило, отличаются большим разнообразием. Это помогает сохранить здоровье вашего ребенка в течение первого года жизни и в последующий период, потому что нет ничего хуже, чем больной ребенок.
Меньше воспалений и хронических заболеваний
Воспаление связано почти со всеми хроническими заболеваниями. Здоровый микробиом помогает контролировать воспаление даже у младенцев, снижая риск диабета, ожирения, сердечных заболеваний и рака.
Снижение риска тревоги и депрессии
Здоровый микробиом может улучшить то, как мы справляемся со стрессом, давая положительную обратную связь нервной системе. Это может снизить долгосрочный риск депрессии и беспокойства.
Здоровая масса тела
Разнообразный микробиом был связан с более здоровой массой тела на протяжении всей жизни.
Улучшение памяти и социального функционирования
Исследования на крысах показали, что микробиом может даже влиять на социальное функционирование и память.Это также может повлиять на здоровое развитие в детстве. Необходимы дальнейшие исследования, чтобы определить точную взаимосвязь между микробиомом и познанием.
В течение первых 2-3 лет жизни микробиом формируется и постоянно меняется. Есть так много факторов, которые могут повлиять на его развитие, и так много возможностей поддержать его развитие. Итак, да, здоровая мать и здоровая беременность могут иметь большое влияние на долгосрочное здоровье младенца, но то, что происходит в первые несколько лет, также имеет большое значение.Микробиом растет вместе с вашим ребенком.
Итак, вы, вероятно, думаете, что вам нужно сразу же принять пробиотик и съесть тонну ферментированных продуктов, чтобы убедиться, что ваш микробиом находится в равновесии. Хотя это может быть полезно, здоровье кишечника и микробиома — это намного больше, чем просто прием таблеток.
Проблема с пробиотиками в том, что бывает сложно понять, какой из них принять. Каждый штамм имеет разные функции и преимущества.Если вы когда-нибудь ходили в магазин в поисках такого товара, вы, вероятно, сбились с толку. Лучшее, что можно сделать при поиске пробиотика, особенно если вы считаете, что у вас микробный дисбаланс, — это поговорить с практикующим, который хорошо разбирается в конкретных штаммах и составах. Этот человек может дать индивидуальные рекомендации относительно того, на чем вам следует сосредоточиться в период до зачатия и во время беременности.
Помимо пробиотиков, есть много других вещей, которые вы можете сделать для улучшения здоровья кишечника до беременности:
- Ешьте ферментированные продукты ежедневно: чайный гриб, квашеная капуста и йогурт — отличный выбор.Это было связано с более низким риском осложнений беременности.
- Управляйте своим стрессом. Слишком сильный стресс нарушает баланс кишечных микробов. Попробуйте медитацию, прогулку на природе или упражнения, чтобы уменьшить стресс. Кроме того, постарайтесь не беспокоиться о беременности! Я знаю, легче сказать, чем сделать.
- Придерживайтесь сбалансированной и питательной диеты. Ограничьте употребление обработанных пищевых продуктов.
- Поддерживайте здоровый вес.
- Избегайте курения и злоупотребления психоактивными веществами.
- Соблюдайте гигиену полости рта.
- Избегайте спринцевания.
- Регулярно занимайтесь спортом
Принятие некоторых из этих привычек поможет сохранить ваш микробиом счастливым, увеличивая вероятность забеременеть и иметь здоровую беременность. Здоровье нашего микробиома — это отражение нашего здоровья, и, как вы узнали, оно также влияет на здоровье будущих поколений.
- Вы годами страдали от проблем с пищеварением?
- Влияют ли симптомы на вашу повседневную жизнь?
- У вас часто бывает запор или жидкий стул? Он колеблется между обоими?
- Вы пробовали пробиотики и не переносите их?
- У вас есть постоянно растущий список продуктов, которые вы не переносите? Ваша пищевая непереносимость ощущается как движущаяся цель?
- У вас частый кислотный рефлюкс?
Если вы ответили утвердительно на любой из вышеперечисленных вопросов или просто знаете, что что-то «не так» с вашим пищеварением, вероятно, вам придется работать с практиком функциональной медицины, который хорошо разбирается в проблемах со здоровьем кишечника и который можете использовать соответствующее тестирование для определения вашего конкретного дисбаланса.Если вы хотите обсудить свои симптомы и разработать план, я предлагаю начальные консультации, которые можно провести лично или виртуально из любого места. Закажите консультацию здесь .
Важность клетчатки во время беременности
Согласно последним рекомендациям по питанию, опубликованным Министерством сельского хозяйства США в 2015 году, клетчатка является одним из наиболее недо потребляемых питательных веществ, что подвергает людей повышенному риску для здоровья. В отчете также упоминается низкое потребление овощей, фруктов и цельнозерновых продуктов в качестве основного причина этого дефицита питания.Хотя цельнозерновые продукты — не самый эффективный способ увеличить количество клетчатки, употребление достаточного количества свежих овощей и фруктов, безусловно, приведет к лучшему количеству клетчатки.
Вместо того, чтобы переходить на лучшую диету, многие взрослые выбирают пищевые добавки с клетчаткой, чтобы компенсировать разницу, но для многих это может быть плохим долгосрочным решением. В естественной диетической форме клетчатка сочетается с множеством витаминов и минералов, которые синергетически усиливают ее пользу для здоровья. Каждый этап жизни зависит от достаточного количества клетчатки, витаминов и минералов для поддержания оптимального здоровья, но беременность — это уникальный этап жизни женщины, на котором адекватное диетическое волокно является обязательным.Оптимальное количество пищевых волокон не только поможет избежать многих осложнений, связанных с беременностью, но и снизит риск проблем со здоровьем у ее ребенка.
Дисбиоз и гестационный диабет
Дисбактериоз кишечной микробиоты является первопричиной многих проблем со здоровьем, но особенно болезней пищеварительной системы и обмена веществ, таких как инсулинорезистентность, диабет 2 типа и ожирение. Многие взрослые люди страдают дисбактериозом различной степени, но изменения, связанные с беременностью, часто усугубляют ее риски, которые могут быть переданы младенцу во время родов и увеличивают риски метаболических проблем со здоровьем у ребенка в более позднем возрасте.Беременность естественным образом вызывает состояние воспаления в кишечнике, позволяя размножаться уже существующим патогенным бактериям.
Было показано, что адекватное количество пищевых волокон защищает от чрезмерного роста Collinsella (филума Actinobacteria ) во время беременности. Collinsella напрямую связана с повышенным уровнем циркулирующего инсулина, изменением всасывания холестерина в кишечнике, снижением гликогенеза в печени и повышенным синтезом триглицеридов.Эти бактерии также снижают экспрессию белков плотных контактов, увеличивая проницаемость кишечника и метаболическую эндотоксемию. У беременных женщин повышенный уровень содержания Collinsella чаще всего связан с нарушением регуляции уровня сахара в крови и изменением метаболизма инсулина, что может привести к гестационному диабету.
Гестационный диабет вызывает множество осложнений со здоровьем, включая гипертонию, преэклампсию, необходимость кесарева сечения, большой вес при рождении, вызывающий роды и осложнения при родах, а также повышенный риск сердечно-сосудистых заболеваний и диабета 2 типа.С ростом распространенности были предприняты усилия по снижению риска развития этого состояния с помощью диетических мер, и потребление клетчатки является решающим фактором, поскольку она благоприятно модулирует микробиоту кишечника. Collinsella обычно встречается у беременных женщин с избыточным весом и ожирением и может частично объяснить, почему эта популяция также подвержена более высокому риску гестационного диабета.
Исследование 130 беременных женщин с избыточным весом и ожирением, у которых измерялось потребление пищевых волокон и анализировалась их кишечная микробиота, показало, что «содержание Collinsella положительно коррелировало с циркулирующим инсулином, независимо от ИМТ матери, но отрицательно с потреблением пищевых волокон.Таким образом, адекватное потребление клетчатки изменяет микробиоту кишечника, повышая уровень инсулина и снижая риски метаболических осложнений, таких как гестационный диабет, а также защищая здоровье младенца.
Целиакия
Совсем недавно было показано, что высокое потребление пищевых волокон во время беременности снижает риск глютеновой болезни у ребенка. Исследователи обнаружили, что на каждые 10 граммов клетчатки, потребляемых ежедневно во время беременности, риск развития глютеновой болезни у ребенка снижался на 8 процентов, а если беременные женщины потребляли более 45 граммов клетчатки в день, риск их ребенка заболеть целиакией снижался на треть по сравнению с детям, чья мать потребляла менее 19 граммов клетчатки в день.Эти результаты были взяты из популяционного исследования, в котором оценивалось более 88 000 детей, родившихся в период с 1999 по 2009 год. Когда эти результаты были объявлены ведущим исследователем на 52-м ежегодном собрании Европейского общества детской гастроэнтерологии, гепатологии и питания (ESPGHAN) в 2019 г. он не смог прокомментировать причину ассоциации; однако другие исследования обнаружили тесную связь между составом микробиоты кишечника, измененным иммунитетом и глютеновой болезнью. Следовательно, эта ассоциация, вероятно, связана со способностью пищевых волокон положительно модулировать микробиоту кишечника.
К сожалению, большинство взрослых потребляют только половину рекомендуемой дневной нормы клетчатки, которая составляет 25 граммов для женщин и 35 граммов для мужчин. Если женщины потребляют в среднем только 12,5 граммов клетчатки в день, их количество намного ниже того количества, которое требуется для поддержания хорошего здоровья как у них самих, так и (в случае беременности) у их потомков. В связи с ростом нарушений обмена веществ и аллергии / непереносимости глютена важно, чтобы практикующие врачи говорили о необходимости диеты с высоким содержанием клетчатки, особенно во время беременности.
.
 Объем — от одного до трех литров в день, по желанию, но не менее литра. «Если пить воду не хочется, надо убрать из рациона сладкие напитки и чаи и компенсировать это чистой водой (желательно сырой, артезианского происхождения, приятной на вкус, а еще лучше талой)». (Т.Г.Садовая, акушер, автор лекции «Питание во время беременности»).
Объем — от одного до трех литров в день, по желанию, но не менее литра. «Если пить воду не хочется, надо убрать из рациона сладкие напитки и чаи и компенсировать это чистой водой (желательно сырой, артезианского происхождения, приятной на вкус, а еще лучше талой)». (Т.Г.Садовая, акушер, автор лекции «Питание во время беременности»). «Масло сладкого миндаля (пищевое) обладает выраженным слабительным эффектом и не раздражает стенки кишечника. Оливковое и льняное и масла, а также масло грецкого ореха тоже обладают мягким слабительным эффектом. Не забудьте, что нерафинированные масла нужно хранить в холодильнике (за исключением оливкового), а льняное желательно употребить в пищу в течение месяца после вскрытия бутылки». (О.Л.Банникова, акушер).
«Масло сладкого миндаля (пищевое) обладает выраженным слабительным эффектом и не раздражает стенки кишечника. Оливковое и льняное и масла, а также масло грецкого ореха тоже обладают мягким слабительным эффектом. Не забудьте, что нерафинированные масла нужно хранить в холодильнике (за исключением оливкового), а льняное желательно употребить в пищу в течение месяца после вскрытия бутылки». (О.Л.Банникова, акушер).
 м.н., педиатр)
м.н., педиатр) «Масла должны быть только пищевые, хорошего качества! Не рекомендуется применять эфирные масла первые 3 месяца беременности. 1й состав — взять 1 капля базилика, 2 капли сосны на маленький кусочек сахара или мед и пососать под языком утром натощак. 2й состав — базилик 30 капель, розовое дерево 20 капель, саро 10 капель и 40 капель масла абрикосовой косточки или любого другого пищевого нерафинированного масла. Перемешать. Употреблять по 3 капли этой смеси под язык на сахаре или меде утро и вечер перед едой 5-7 дней или как есть необходимость». ОБЯЗАТЕЛЬНО уточните при покупке аромамасел, есть ли информация на упаковке, о том, что данное масло можно употреблять в пищу. (О.Л.Банникова, акушер)
«Масла должны быть только пищевые, хорошего качества! Не рекомендуется применять эфирные масла первые 3 месяца беременности. 1й состав — взять 1 капля базилика, 2 капли сосны на маленький кусочек сахара или мед и пососать под языком утром натощак. 2й состав — базилик 30 капель, розовое дерево 20 капель, саро 10 капель и 40 капель масла абрикосовой косточки или любого другого пищевого нерафинированного масла. Перемешать. Употреблять по 3 капли этой смеси под язык на сахаре или меде утро и вечер перед едой 5-7 дней или как есть необходимость». ОБЯЗАТЕЛЬНО уточните при покупке аромамасел, есть ли информация на упаковке, о том, что данное масло можно употреблять в пищу. (О.Л.Банникова, акушер)