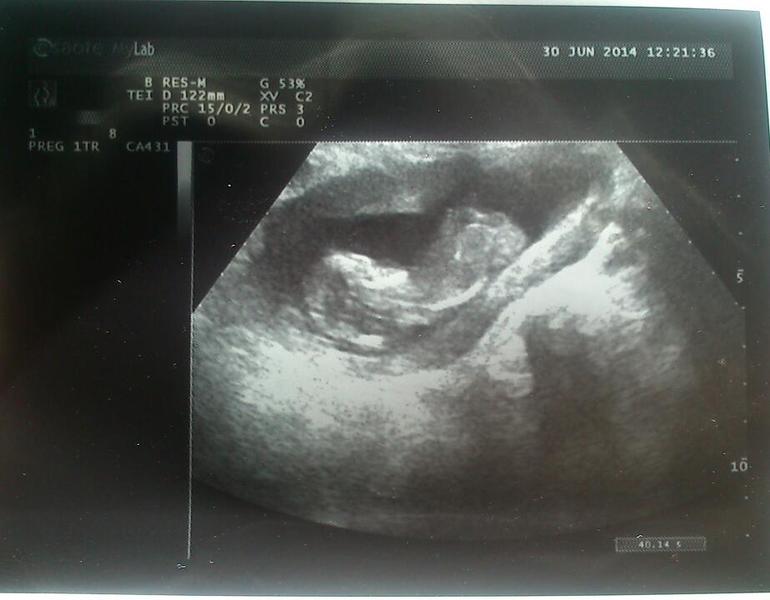
КТГ при беременности – полезная и безопасная процедура
Такой вид пренатальной диагностики показывает динамику жизнедеятельности плода, частоту его сердечных ударов, двигательную активность. Показатели могут меняться в зависимости от времени суток, срока вынашивания, самочувствия матери и некоторых раздражителей. КТГ при беременности не надо воспринимать как диагноз. Современная аппаратура в центре «ЭСКУЛАП+», работает на допплеровском эффекте. Сведения в виде цифр, звуков и световых сигналов выводятся на ленту. Полученные картинки называют кардиотокограммами.
Что показывает кардиотокография
Процедуру проводят в амбулаторном режиме, начиная с 32 недели при нормальном течении гестации. Если есть показания, к ней прибегают раньше положенного срока.
Исследование назначают всем без исключения. Комплексное обследование помогает выяснить самочувствие ребенка, сможет ли он сам пройти по родовому каналу без врачебной помощи.
Манипуляция отслеживает шевеление плода, ЧСС, определяет тонус матки.
При проведении кардиотокографии выявляют либо опровергают следующие патологии:
- Быстрое старение плаценты;
- Проблемы со стороны сердечной деятельности;
- Гипоксия;
- Много- или маловодие;
- Фетоплацентарная недостаточность.
На основании полученных показателей возможно вовремя выяснить проблемы со здоровьем, предупредить при родах несчастный случай. Поэтому значение КТГ при беременности переоценить сложно. При обнаружении проблем врач проведет коррекцию ведения беременной женщины, назначит или наоборот отменит препараты.
Показания и противопоказания
Манипуляция назначается в целях мониторинга плодоношения, протекающего как с осложнениями, так и без. Она позволяет выяснить, есть ли отклонения в развитии ребенка, и какие именно.
Например, если у малыша ди-стресс, необходима срочная терапия, иногда искусственное родоразрешение. Оценивается жизнедеятельность плода перед родами или во время них, мониторинг ЧСС, тонуса матки.
Оценивается жизнедеятельность плода перед родами или во время них, мониторинг ЧСС, тонуса матки.
Дополнительно КТГ при беременности делают при угрозе выкидыша, многоплодии, отрицательном резусе материнской крови, гипертензии, проблемах с сердцем и эндокринной системой.
Процедура рекомендована при неблагополучном акушерском анамнезе. Например, при неспособности к зачатию, регулярных выкидышах, и если были ранние роды в прошлом. Исследование проводится пациенткам, инфицированным ВИЧ и состоящим в группе риска: алко- и наркозависимым.
При полном отсутствии жалоб, анализ делают однократно. По показаниям, его повторяют спустя пару часов или суток.
Противопоказаний к кардиотокографии нет, повторять ее можно столько, сколько потребуется. Она легко переносится пациентками, так как не вызывает побочных реакций и не доставляет никакого дискомфорта.
Частота и сроки обследования
 Поэтому проводить анализ лучше с 32-33 недели беременности. КТГ получается качественно и более точно, а результаты легко расшифровываются. Ранняя диагностика далеко не всегда достоверна и информативна, до 28 недель процедуру назначают только в особых случаях.
Поэтому проводить анализ лучше с 32-33 недели беременности. КТГ получается качественно и более точно, а результаты легко расшифровываются. Ранняя диагностика далеко не всегда достоверна и информативна, до 28 недель процедуру назначают только в особых случаях.За последний период вынашивания, в соответствии с предписанием Минздрава РФ, делают 2 –3 осмотра в плановом режиме. Этого вполне достаточно, если развитие ребенка протекает без особенностей и осложнений.
Кардиотокография назначается один раз в семь дней при:
- Многоводии;
- Тиреотоксикозе;
- Плацентарной недостаточности;
- Болезнях ССС;
- Женщинам, чей возраст более 35 лет.
При узком тазе, ХПН, гипертоническом синдроме, многоплодной гестации или крупных размерах плода — один раз в 10 дней. При несовместимости резуса или группы крови — раз в две недели. Если плодоношение длится 42 недели или больше, обследование проводят каждые 4–5 дней.
Будущие мамы часто беспокоятся о состоянии здоровья ребенка, и о том, нормально ли он чувствует себя в утробе. Кардиотокография помогает получить точную информацию о его развитии. Метод КТГ при беременности в центре «ЭСКУЛАП+» проходит на высокоточном оборудовании, абсолютно безопасном для матери и малыша.
Роль шейки матки при беременности – публикации клиники «ТрастМед»
Шейка матки является иммунокомпетентным органом. Волокна коллагена (80% от всех структурных единиц шейки матки) и эластина, являющие собой основу структуры внеклеточного матрикса, окружены огромным количеством иммунокомпетентных клеток. Каскад цитокиновых реакций при иммунном ответе на воспалительную альтерацию вызывает структурные изменения в шейке матки. При низком уровне прогестерона запускаются провоспалительные цитотоксические реакции, в результате которых разрушаются и фибриллы коллагена (его содержание снижается до 30-50%), и сам внеклеточный матрикс.
Формирование истмико-цервикальной недостаточности можно только предупредить, желательно ещё во время предгравидарной подготовки. Особенно такая подготовка важна женщинам группы риска (невынашивание и преждевременные роды в анамнезе, недостаточность лютеиновой фазы менструального цикла и т.д.). Назначение препаратов прогестерона при клинически выраженной истмико-цервикальной недостаточности не позволит восстановить нормальную структуру соединительной ткани шейки матки или увеличить её длину, а также не активирует синтез новых волокон коллагена. Не поможет даже назначение нескольких гестагенов и/или их высоких доз. Целью назначения прогестерона в этом случае будет максимальное пролонгирование беременности за счёт снижения тонуса матки.
Применение прогестерона даёт хороший эффект — снижение риска преждевременных родов. Так, назначение этих препаратов беременным группы риска невынашивания беременности и преждевременных родов позволило в разы сократить частоту потери беременности, сравнив её с таковой в группе женщин без отягощенного анамнеза. Кроме того, при использовании доз в пределах «терапевтического коридора» побочные эффекты не развивались.
Так, назначение этих препаратов беременным группы риска невынашивания беременности и преждевременных родов позволило в разы сократить частоту потери беременности, сравнив её с таковой в группе женщин без отягощенного анамнеза. Кроме того, при использовании доз в пределах «терапевтического коридора» побочные эффекты не развивались.
В клинике «ТРАСТМЕД» принимают высококвалифицированные акушеры-гинекологи, имеющие многолетний опыт планирования и ведения беременности у женщин с отягощенным акушерско-гинекологическим анамнезом, которые помогут Вам подготовиться к беременности и приложат все усилия для того, чтобы Ваша беременность закончилась рождением долгожданного и здорового ребенка!
КГТ ребенка при беременности — профессиональная диагностика и расшифровка результатов

С какой целью проводится КТГ беременным?
Кардиотокография плода позволяет оценить кровоснабжение плода и тонус матки на поздних сроках беременности. В исследовании фиксируется ритм сердцебиения младенца, который, в норме, учащается только при движении. Оценка ритма сердцебиения показывает, достаточно ли кровоснабжение плода, нет ли оснований для дополнительного обследования / лечения.
В каком случае необходимо КТГ?
Планово КТГ проводится всем беременным на каждом приеме, начиная с 30 недель до родов.
Внепланово КТГ проводится при гипертонусе матки, слишком сильной или, наоборот, малой активности движений плода.
ВНИМАНИЮ БЕРЕМЕННЫХ! Если малыш ведет себя нехарактерно, обратитесь к врачу акушеру-гинекологу — возможно, требуется проведение кардиотокографии!
Как проходит исследование?
Длительность процедуры составляет около 30 минут. Процедура не требует предварительной подготовки. Беременная женщина лежит на кушетке с накожными датчиками, нажатием на кнопку отмечает движения плода.
Достоинства исследования
- высокая доступность исследования: не требуется специальная подготовка; проводится в любое время;
- не инвазивный и безболезненный метод исследования;
- безопасность исследования: отсутствие лучевой нагрузки;
- информативность, позволяющая уточнить состояние плода и матки.
КТГ в Семейной клинике «КОСМА» проводят высококвалифицированные специалисты отделения акушерства и гинекологии, имеющие специализированный опыт снятия и расшифровки кардиотокографии плода. Исследование проводится в комфортной обстановке. Результаты выдаются в день приема. Исследование могут пройти как пациентки, наблюдающиеся в клинике, так и беременные женщины, обратившиеся только для проведения данной процедуры.
Заключительные недели беременности — время, требующее особой заботы о будущей маме и малыше. Мы рады помочь сохранить Ваше здоровье и гармонию в этот важный период!
В клинике «КОСМА» Вас ждет комплекс необходимых приемов и обследований, необходимый для высокквалифицированного ведения беременности, комфорт и забота о каждой будущей маме!
| беременность
Осмотр коровы 295-302 Цель любого метода, используемого для проведения беременности обследование для определения статуса беременности по:
Методика диагностики беременности по ректальная пальпация втягивающейся матки ВТЯНУТЬ, ВТЯНИТЬ, ВТЯНИТЬ !!!!! Вы должны отозвать матка полностью и аккуратно. Второй , почувствуйте жидкость в большом роге.Жидкость имеет гладкое бархатистое ощущение, потому что стенка матки истончается во время беременность. Жидкость почти похожа на воздушный шар, который не полностью заполнен. Третий , Вы должны систематически чувствовать
матка для амниотического пузыря, слизистой оболочки плода или плода.
(семядоли не появятся примерно до 75 дней). Несмотря на то что
CL3 находится на ипсилатеральном яичнике 99.9% случаев, и это может помочь
чтобы идентифицировать беременный рог, это , а не положительный признак беременности. Всегда следуй
золотые правила диагностики беременности. Методика диагностики беременности по ректальная пальпация невыдвижной матки Попроб.
тяжело втягивать матку и осматривать весь тракт. Другие признаки наводящие на размышления беременных — это фремитус, который представляет собой гипертрофию средней части матки.
артерия. Среднюю маточную артерию можно захватить широкой связкой.
и двинулся. Возникает турбулентность жидкости, которая дает «гудение»
ощущение артерии. Вы должны исключить внешнюю подвздошную кость. Оценка срока беременности по ректальная пальпация Зачем тебе нужно оцените срок беременности?
Техника: Жидкость еле пальпируется в 28 дней, хотя это не положительный признак беременности. амниотический Vesicle (не рекомендуется для студентов пальпация) AV можно пальпировать до 2 недель.
после раздавлен. Это тот случай, когда вы обнаружите положительный признак
беременность, но корова не беременна.
32 дня нить 1 рог Семядоли (на самом деле плацентома,
семядоли / карункул). 75 дней размер гороха Плод Плод опускается вне досягаемости с 3-7 месяцев. Fremitus Дифференциальная диагностика беременности по ректальная пальпация
Признаки проблем с беременностью, отмеченные ректальная пальпация
Резюме ректальной пальпации при беременности Диагностика
Внешний
Интраректально
Это изображение бычьего концептуса, идентифицированного как удлиненная, заполненная жидкостью структура, занимающая несколько витков рог матки. Ультразвуковое изображение вытянутой (слева) и
поперечный (правый)
Ранний Фактор беременности Проверять эта ссылка на потенциально интересный метод определения крупного рогатого скота беременность.
|
Границы | Дефицит релаксина приводит к дисфункции маточной артерии во время беременности у мышей
Введение
Нормальный рост и развитие плода зависит от адекватной доставки кислорода и питательных веществ к плаценте в сочетании с резким увеличением сердечного выброса матери, объема плазмы и кровотока в матке матери (Osol and Mandala, 2009; Conrad and Davison, 2014) .Многие из этих материнских сердечно-сосудистых адаптаций находятся под влиянием циркулирующих стероидных гормонов и факторов роста (Chang and Lubo, 2008; Hu et al., 2011; Corcoran et al., 2014). Несмотря на увеличение кровотока в матке, общее перфузионное давление матки во время беременности остается относительно постоянным из-за снижения сосудистого сопротивления. Структурные и функциональные адаптации маточных артерий во время беременности опосредуют снижение сосудистого сопротивления в этом сосудистом русле (Veerareddy et al. , 2002; Осол и Мандала, 2009; Мандала и Осол, 2012). Неспособность сосудистой сети матки должным образом адаптироваться к беременности ставит под угрозу перфузию плаценты, при этом хроническое снижение маточного кровотока связано с задержкой роста плода и смертью (Lang et al., 2003).
, 2002; Осол и Мандала, 2009; Мандала и Осол, 2012). Неспособность сосудистой сети матки должным образом адаптироваться к беременности ставит под угрозу перфузию плаценты, при этом хроническое снижение маточного кровотока связано с задержкой роста плода и смертью (Lang et al., 2003).
Сужение сосудов в ответ на повышение внутрипросветного давления, миогенный тонус, является фундаментальным свойством, регулирующим кровоток во многих артериях (Veerareddy et al., 2002; Davis, 2012). На поздних сроках беременности миогенный тонус значительно снижается в маточных, брыжеечных и почечных артериях (Sherwood et al., 1980; Мейер и др., 1993; Новак и др., 2002; Veerareddy et al., 2002; Кук и Дэвидж, 2003; Xiao et al., 2010). Снижение миогенного тонуса маточных артерий вместе с дополнительными функциональными адаптациями, включая усиление эндотелий-зависимой вазодилатации и рефрактерности гладких мышц к вазоконстрикторным стимулам (Ni et al., 1997; Veerareddy et al., 2002; Cooke and Davidge, 2003; Chang и Lubo, 2008; Withers et al. , 2009; Hu et al., 2011), все они способствуют усилению перфузии маточно-плацентарной единицы.Неполная функциональная и структурная адаптация сосудистой сети матки во время беременности приводит к серьезным осложнениям беременности, включая задержку роста плода, гипертонию во время беременности и преэклампсию (Osol and Mandala, 2009).
, 2009; Hu et al., 2011), все они способствуют усилению перфузии маточно-плацентарной единицы.Неполная функциональная и структурная адаптация сосудистой сети матки во время беременности приводит к серьезным осложнениям беременности, включая задержку роста плода, гипертонию во время беременности и преэклампсию (Osol and Mandala, 2009).
Пептидный гормон релаксин играет важную роль в опосредовании некоторых материнских почечных и системных гемодинамических адаптаций во время беременности (Conrad and Davison, 2014). Наибольшие циркулирующие концентрации релаксина наблюдаются во время беременности с разными уровнями у разных видов.Пик уровня релаксина приходится на последнюю половину беременности у грызунов (Sherwood et al., 1980), но в конце первого триместра у людей (Stewart et al., 1990). С повышением уровня релаксина у беременных связано снижение сопротивления маточных и почечных артерий (Smith et al., 2006). Важно отметить, что женщины с недостаточностью яичников, которые зачат с донорскими яйцеклетками, оплодотворением in vitro, или переносом эмбриона (без измеримого циркулирующего релаксина), не подвергаются системной вазодилатации во время беременности и имеют повышенный риск развития неблагоприятных исходов беременности (Конрад и Дэвисон, 2014).
В нескольких исследованиях изучалось влияние эндогенного релаксина на сосудистую сеть матки во время беременности. Рецепторы релаксина (RXFP1) обнаруживаются в почечных артериях мышей и крыс, аорте (Novak et al., 2006; Ferreira et al., 2009; Jelinic et al., 2014) и маточных артериях (Vodstrcil et al., 2012) беременных. мыши и крысы. Введение моноклональных антител (MCA1) для нейтрализации циркулирующего релаксина у беременных крыс ослабляло почечную и системную вазодилатацию (Novak et al., 2001) и увеличивало пассивную периферическую жесткость стенки маточной артерии (Vodstrcil et al., 2012). Это было первое доказательство того, что дефицит релаксина может влиять на функцию сосудов во время беременности. Более поздние исследования на мышах с дефицитом релаксина ( Rln — / — ) продемонстрировали нарушение реактивности брыжеечной артерии (Marshall et al., 2016, 2017a) и нарушение ремоделирования маточной артерии (Gooi et al., 2013), связанное с более жесткими маточными артериями. и снижение веса плода. В этом исследовании мы проверили гипотезу о том, что дефицит релаксина во время беременности нарушает нормальную адаптацию функции маточной артерии, тем самым влияя на рост плода.Цели этого исследования состояли в том, чтобы выяснить, есть ли дефицит релаксина: (i) повышенный миогенный тонус маточной артерии во время беременности и (ii) нарушение эндотелий-зависимой вазодилатации, вызванной агонистами. Мультигенный количественный ПЦР-массив также использовался для исследования сигнальных молекул, лежащих в основе измененных механизмов функции маточной артерии.
и снижение веса плода. В этом исследовании мы проверили гипотезу о том, что дефицит релаксина во время беременности нарушает нормальную адаптацию функции маточной артерии, тем самым влияя на рост плода.Цели этого исследования состояли в том, чтобы выяснить, есть ли дефицит релаксина: (i) повышенный миогенный тонус маточной артерии во время беременности и (ii) нарушение эндотелий-зависимой вазодилатации, вызванной агонистами. Мультигенный количественный ПЦР-массив также использовался для исследования сигнальных молекул, лежащих в основе измененных механизмов функции маточной артерии.
Материалы и методы
Животные
Все эксперименты на животных были одобрены Комитетом по этике экспериментов на животных Мельбурнского университета (AECC 1212387) и проводились в соответствии с Кодексом практики Австралии и руководящими принципами Национального совета по здравоохранению и медицинским исследованиям.В этом исследовании использовались мыши Rln — / — , скрещенные на фоне C57BL / 6J с поколением F 14 и однопометники дикого типа ( Rln + / + ) той же линии (Zhao et al. ., 1999). Мышей содержали в помещении животноводческого комплекса Мельбурнского университета, расположенном в Школе биологических наук, при цикле 12 часов свет: 12 часов темноты при 20 ° C, с доступом к стандартным кормовым гранулам (Barastock, Pakenham, Vic, Australia) и воде. ad libitum . Генотипы мышей подтверждали анализом ушных зажимов с помощью ОТ-ПЦР, как описано ранее (Zhao et al., 1999). Соответствующего возраста (3–5 месяцев) Rln + / + и Rln — / — мышей изучали в двух когортах, небеременных (течка) и поздних беременных (17,5 день беременности).
., 1999). Мышей содержали в помещении животноводческого комплекса Мельбурнского университета, расположенном в Школе биологических наук, при цикле 12 часов свет: 12 часов темноты при 20 ° C, с доступом к стандартным кормовым гранулам (Barastock, Pakenham, Vic, Australia) и воде. ad libitum . Генотипы мышей подтверждали анализом ушных зажимов с помощью ОТ-ПЦР, как описано ранее (Zhao et al., 1999). Соответствующего возраста (3–5 месяцев) Rln + / + и Rln — / — мышей изучали в двух когортах, небеременных (течка) и поздних беременных (17,5 день беременности).
Сбор образцов и изоляция маточной артерии
В день эксперимента мышей взвешивали, анестезировали 2% изофлуораном и подвергали эвтаназии путем смещения шейных позвонков. Маточные артерии выделяли в ледяной физиологический раствор Кребса с HEPES (PSS-HEPES), содержащий (мМ): NaCl 112, NaHCO 3, 25, KCl 4.7, MgSO 4 1,2, KH 2 PO 4 0,7, HEPES 10, D -глюкоза 11,6 и CaCl 2 2,5 (pH 7,4). Основные маточные артерии тщательно очищали от рыхлой соединительной и жировой ткани. Правую маточную артерию использовали для миографии давления, а левую — для проволочной миографии. Остальные сегменты артерий мгновенно замораживали в жидком азоте и хранили при -80 ° C для последующего анализа.
Миография давления
Сегменты маточной артерии без утечек канюлировали на стеклянных микропипетках миографа давления (Living Systems Instrumentation, Burlington, VT, USA) и измеряли внешний диаметр с помощью видеомикроскопии (Diamtrak software, Adelaide, SA, Australia).Эксперименты проводились при отсутствии внутрипросветного кровотока при непрерывной суперфузии (4 мл / мин) с PSS-HEPES при 37 ° C. В начале каждого эксперимента артерии акклиматизировались в течение 40 мин при 50 мм рт. Ст. Затем проверяли жизнеспособность гладких мышц и эндотелиальных клеток, как описано ранее (Tare et al., 2011). Развитие миогенного тонуса оценивали в диапазоне внутрипросветного давления 10–120 мм рт. Ст. (10, 30, 50, 60, 80, 100, 120 мм рт. Ст.) С приращениями давления каждые 10 мин. Это повторяли через 30 минут предварительной инкубации с N ω -нитро- L -аргининовым метиловым эфиром (L-NAME; 200 мкмоль / л) и L-NAME и индометацином (Indo; 1 мкмоль / л) для получения изучить вклад оксида азота (NO) и простаноидов, соответственно, в модуляцию миогенного тонуса.Чтобы определить пассивные диаметры артерий при каждом давлении, в конце каждого эксперимента протокол повышения давления повторяли с кальцием (Ca 2+ ), содержащим PSS-HEPES, с 0 ммоль / л и 2 мМ EGTA (через 30 мин. предварительная инкубация в буфере).
Проволочная миография
Агонист-индуцированная сосудистая реактивность оценивалась, как описано ранее (Leo et al., 2014a, b). Вкратце, основные маточные артерии длиной ~ 2 мм устанавливали на четырехканальном проводном миографе (Danish Myo Technology, Орхус, Дания).Чтобы исследовать сокращение, опосредованное альфа-адренорецепторами, артерии подвергали кумулятивному воздействию возрастающих концентраций агониста альфа-адренорецепторов 1 , фенилэфрина (ПЭ, 1–0,1 ммоль / л). Сокращения выражали в процентах от сокращения, вызванного 100 мМ физиологического раствора с высоким содержанием калия (KPSS, изотоническая замена Na + на K + ). Чтобы оценить эндотелий-зависимую и независимую вазодилататорную функцию, маточные артерии предварительно сокращали до аналогичного уровня (60–70% от максимального сокращения KPSS) с использованием PE (0.1–3 мкмоль / л) и кривые концентрация-ответ для эндотелий-зависимых агонистов ацетилхолина (ACh, от 0,1 нмоль / л до 10 мкмоль / л) или брадикинина (BK, от 0,1 нмоль / л до 1 мкмоль / л), и эндотелий-независимые агонисты нитропруссид натрия (SNP, от 0,1 нмоль / л до 10 мкмоль / л) и илопрост (от 0,1 нмоль / л до 1 мкмоль / л) (Marshall et al., 2016). Расслабление выражали в процентах от уровня предварительного сужения. Ответы на ACh и BK также исследовали через 30 мин инкубации с различными комбинациями фармакологических блокаторов, включая L-NAME и Indo.Остаточное расслабление после блокады синтазы оксида азота (NOS) и циклооксигеназы (COX) объясняется гиперполяризацией эндотелия (EDH). Вклад активированных кальцием калиевых каналов средней и малой проводимости в опосредованную EDH релаксацию оценивали путем предварительной инкубации с TRAM-34 (5 мкмоль / л) и апамином (0,1 мкмоль / л), соответственно, в присутствии L -ИМЯ + Индо.
Массив количественной ПЦР
Замороженные маточные артерии беременных Rln + / + ( n = 5) и Rln — / — ( n = 5) мышей помещали в предварительно охлажденные Wig-L-Bug . ® и измельчили в амальгаматоре Digital Wig-L-Bug ® (Dentsply-Rinn, Элгин, Иллинойс, США).Измельченные ткани ресуспендировали в 1 мл TriReagent (Ambion Inc., Scoresbury, VIC, Australia), а затем общую РНК экстрагировали, как описано ранее, с дополнительной заключительной промывкой в 70% этаноле (Vodstrcil et al., 2012; Leo et al., 2014b). Осадки РНК ресуспендировали в 12 мкл RNA Secure ™ (Ambion). Количество РНК анализировали с использованием спектрофотометра NanoDrop ® ND100 (Thermo Fischer Scientific Australia Pty Ltd, Скорсби, Виктория, Австралия) с отношениями A 260 : A 280 > 1.8, что свидетельствует о достаточном качестве для анализа количественной ПЦР. В среднем накопленная маточная артерия 4 беременных мышей (после функциональных исследований) дала ~ 0,7 мкг РНК для создания 1 точки данных, оставляя недостаточно РНК для проверки целостности с помощью гель-электрофореза. Синтез первой цепи кДНК выполняли с использованием набора RT 2 First Strand Kit (QIAGEN, Chadstone, VIC, Australia) в соответствии с инструкциями по набору с использованием 0,5 мкг общей РНК на реакцию. QPCR выполняли с использованием RT 2 Profiler TM PCR Hypertension Array для мышей, анализирующих 84 гена (QIAGEN; Cat.No. PARN-037Z) в соответствии с инструкциями по набору для установки для ПЦР AB Applied Biosystems ViiA7 (Life Technologies, Mulgrave, VIC, Australia) в быстрых реакциях объемом 20 мкл. β-актин ( Actb ), β-глюкуронидаза ( Gusb ) и белок теплового шока 90-α-B1 ( Hsp90ab1 ) были эталонными генами, выбранными производителем. Для каждого гена среднее значение Ct для эталонных генов вычитали из среднего значения Ct интересующего гена для нормализации представляющего интерес гена относительно эталонных генов.Кратность разницы и статистические различия в экспрессии между Rln + / + и Rln — / — мышей для каждого гена были рассчитаны с использованием центра анализа данных QIAGEN GeneGlobe с использованием метода 2 −Δ Ct анализа.
Кривая частотного распределения плода и масса плаценты
Плоды собирали лапаротомией, промокали и измеряли влажный вес (количество плодов, Rln + / + = 161 из 21 л и Rln — / — = 150 из 17 л).Гистограммы были построены с измерениями и рассчитан 5-й процентиль веса, как описано ранее (Dilworth et al., 2011). После отделения плаценты плодные оболочки удаляли, и плаценты сушили на тканях перед взвешиванием (количество плаценты, Rln + / + = 36 из 7 л и Rln — / — = 40 из 8 л. ).
Химические вещества
Все препараты были приобретены у Sigma-Aldrich. Лекарства растворяли в дистиллированной воде, за исключением индометацина (0.1 моль / л карбоната натрия) и TRAM-34 (диметилсульфоксид) с последующими разбавлениями в дистиллированной воде.
Расчеты и статистический анализ
Все результаты выражены как среднее ± SEM; «N» представляет количество животных в группе, за исключением анализа генов, где каждое «n» представляет объединенные основные маточные артерии от n = 3-5 животных. Миогенный тонус рассчитывали как ((D 1 — D 2 ) / D 1 ) × 100, где D 1 — внешний диаметр в PSS без Ca 2+ , а D 2 — это наружный диаметр в присутствии внеклеточного Ca 2+ .Относительный вклад NO и простаноидов вазодилататора в регуляцию миогенного тонуса определяли путем анализа площади под кривой (AUC). Вкратце, роль простаноидного компонента вазодилататора рассчитывалась путем вычитания AUC в присутствии L-NAME + Indo из значения, полученного только для L-NAME. Точно так же компонент ответа, опосредованный NO, определяли вычитанием AUC в L-NAME из AUC, полученного в отсутствие ингибиторов.
Для экспериментов с проволочной миографией сигмовидные кривые были подогнаны к данным реакции на концентрацию, индуцированной агонистами, с использованием метода наименьших квадратов (Prism version 6.0, GraphPad Software, Сан-Диего, Калифорния, США) для расчета чувствительности каждого агониста (pEC 50 ). Максимальное расслабление (R макс ) для ACh, BK, SNP и илопроста измерялось как процент предварительного сжатия до PE. Относительный вклад NO, простаноидов, расширяющих сосуды, и EDH в релаксацию, вызванную ACh или BK, определяли путем анализа AUC кривых ответа ACh или BK, как описано ранее (Marshall et al., 2017b). Вклад Ca 2+ -активированного калиевого канала (IK Ca ) с промежуточной проводимостью в EDH-опосредованную релаксацию определяли путем вычитания AUC в L-NAME + Indo + TRAM-34 из значения, полученного с L-NAME + Indo .Точно так же вклад калиевого канала с низкой проводимостью Ca 2+ (SK Ca ) в EDH-опосредованную релаксацию определяли путем вычитания AUC в L-NAME + Indo + TRAM-34 + апамин из L-NAME +. Индо + ТРАМВАЙ-34. Групповые значения pEC , 50, , R max и AUC сравнивали с использованием однофакторного дисперсионного анализа с апостериорным анализом Бонферрони или независимыми тестами Стьюдента t . Кривые концентрация-ответ были также проанализированы с помощью двухфакторного дисперсионного анализа с использованием апостериорного анализа Bonferroni (лечение vs.концентрация). P <0,05 считали статистически значимым. Оценка средних предельных значений веса плода и плаценты с поправкой на самку и размер помета была проанализирована с помощью SPSS (версия 25.0, SPSS, Чикаго, Иллинойс, США).
Результаты
Влияние дефицита релаксина на развитие миогенного тонуса
Дефицит релаксина не влияет на развитие миогенного тонуса в маточных артериях небеременных мышей
Маточные артерии небеременных мышей Rln + / + и Rln — / — развили миогенный тонус с внутрипросветным повышением давления в присутствии Ca 2+ (рисунок 1A).Величина развития миогенного тонуса существенно не различалась между маточными артериями небеременных Rln + / + и Rln — / — животных (Фигуры 1A, B). Вазодилататоры эндотелия могут модулировать развитие миогенного тонуса. Здесь мы исследовали вклад NO и простаноидов, расширяющих сосуды, в этой роли. После ингибирования активности NOS с помощью L-NAME, развитие миогенного тонуса в маточных артериях значительно увеличилось с Rln + / + ( P = 0.02) и Rln — / — ( P = 0,02) мышей (Фигуры 1C, D). Последующее ингибирование синтеза простаноидов вазодилататора с помощью Indo в присутствии L-NAME не имело дальнейшего значительного эффекта (Фигуры 1C, D). Анализ AUC показал, что общая величина повышения тонуса в присутствии ингибирования NOS и COX не различалась у мышей Rln + / + и Rln — / — (фигура 1E). У небеременных мышей сосудорасширяющие простаноиды играют незначительную роль в модуляции миогенного тонуса маточной артерии.В отсутствие Ca 2+ не было обнаружено различий между пассивным наружным диаметром маточных артерий мышей Rln + / + и Rln — / — . При беременности произошло значительное увеличение пассивного наружного диаметра маточной артерии ( P, <0,0001; Рисунок 1F) без различий между генотипами.
Рисунок 1 . Развитие миогенного тонуса в основной маточной артерии небеременных мышей Rln + / + (закрашено черным цветом) и Rln — / — мышей (закрашено белым) ( n = 5 на группу). (A) Развитие миогенного тонуса с увеличением давления (мм рт. Ст.) И (B) площадь под кривой (AUC). Миогенный тонус основной маточной артерии у небеременных мышей (C) Rln + / + и (D) Rln — / — после предварительной обработки артерий без (квадрат; контроль ) или с ингибитором NOS (треугольник) L-NAME или (ромб) L-NAME и ингибитором COX Indo (L-NAME + Indo). (E) AUC анализ относительного вклада NO и вазодилататора простаноидов (PG) в развитие миогенного тонуса в маточных артериях небеременных мышей Rln + / + и Rln — / — . (F) Пассивные наружные диаметры основных маточных артерий после внутрипросветного повышения давления (10–120 мм рт. поздняя беременность (d17,5; квадраты) ( n = 6–8 на группу). * P <0,05 двухфакторный контроль ANOVA по сравнению с L-NAME (C, D) или не беременная по сравнению с беременной (F) ; # P <0,05 односторонний контроль ANOVA по сравнению с PG; * П <0.05 односторонний ANOVA NO против PG (E) .
Развитие миогенного тонуса в маточных артериях у беременных мышей с дефицитом релаксина
На поздних сроках беременности развитие миогенного тонуса все еще происходило в маточных артериях беременных мышей Rln + / + и Rln — / — . Миогенный тонус был значительно ослаблен в артериях беременных мышей Rln + / + (фиг. 2A, P <0,0001). Анализ AUC показал, что общее развитие миогенного тонуса в маточных артериях у мышей Rln — / — было вдвое больше, чем у мышей Rln + / + ( P <0.01, рисунок 2B).
Рисунок 2 . Развитие миогенного тонуса в маточных артериях поздних беременных мышей Rln + / + и Rln — / — . Миогенный тонус: (A) с повышением давления (мм рт. Ст.) И (B) площадь под кривой (AUC). ( n = 8–9 на группу). Миогенный тонус: поздно беременные (C) Rln + / + и (D) Rln — / — мыши после предварительной обработки артерий без (квадраты) или с ингибитором NOS ( треугольник) L-NAME или (ромбики) L-NAME и ингибитор ЦОГ Indo (L-NAME + Indo).Вклад NO и простаноидов вазодилататора (PG) в миогенный тонус анализируется как AUC ( n = 5–9 на группу) в основной маточной артерии беременной (E) и сравнивается между (F) небеременными (NP) и беременных (d17.5) Rln + / + и Rln — / — мышей. Данные представлены как среднее ± стандартная ошибка среднего. * P <0,05 по сравнению с генотипом, двусторонний ANOVA (A) , # P <0,05 между генотипами, критерий Стьюдента t , * P <0.05 по сравнению с контролем, двусторонним контролем ANOVA против L-NAME (C, D) ; ∧ P <0,05 односторонний контроль ANOVA против NO, * P <0,05 односторонний контроль ANOVA против NO (E) ; α P <0,05 односторонний дисперсионный анализ NO по сравнению с PG (E) . λ P <0,05 двусторонний дисперсионный анализ с факторами статуса беременности или эндотелиальными факторами (F) .
Обработка только L-NAME значительно увеличивала развитие миогенного тонуса в артериях обеих Rln + / + ( P = 0.04) и Rln — / — мышей ( P = 0,0005, Фигуры 2C, D). Подавление синтеза простаноидов не имело дальнейшего значительного эффекта. Анализ AUC показал, что как NO ( P = 0,007), так и простаноиды ( P = 0,002) вносят важный и значительный вклад в регуляцию миогенного тонуса у здоровых беременных мышей Rln + / + (рис. 2E). . Для маточных артерий мышей Rln — / — анализ AUC показал, что, хотя и NO, и простаноиды вазодилататора способствуют регуляции миогенного тонуса, роль NO была значительно выше ( P <0.0001; Рисунок 2E).
При сравнении общей AUC миогенного тонуса в маточных артериях небеременных и беременных мышей очевидно, что, хотя у мышей Rln — / — усилена регуляция компонента NO, увеличения простаноидного компонента не наблюдается. у этих мышей во время беременности. Повышенная регуляция простаноидного компонента была отмечена в маточных артериях Rln + / + во время беременности (рис. 2F).
Эндотелий-зависимая релаксация, индуцированная агонистами
Эндотелиальная дисфункция в маточных артериях небеременных мышей с дефицитом релаксина
ACh индуцировал зависимое от концентрации расслабление в артериях у мышей Rln + / + и Rln — / — (Фигуры 3A, B).Чувствительность к ACh была снижена в два раза (pEC 50 , P <0,05), а общая AUC для релаксации была значительно снижена у небеременных Rln — / — по сравнению с Rln + / + мышей (рис. 3C; таблица 1). Максимальная релаксация не различалась между артериями мышей Rln + / + и Rln — / — (Таблица 1).
Рисунок 3 . Кривые концентрация-ответ для эндотелий-зависимого агониста ацетилхолина (ACh) в основных маточных артериях небеременных мышей (A) Rln + / + и (B) Rln — / — мышей в отсутствие (кружок; контроль) или в присутствии ингибитора NOS (треугольник) L-NAME или (ромб) L-NAME и ингибитора COX Indo (L-NAME + Indo). (C) Анализ площади под кривой (AUC) вклада оксида азота (NO), сосудорасширяющих простаноидов (PG) и гиперполяризации эндотелия (EDH) в индуцированное ACh расслабление в основных маточных артериях небеременной женщины Rln + / + и Rln — / — мышей и (D) изменение максимальной эндотелий-зависимой релаксации (R max ) после инкубации с L-NAME или L-NAME + Indo; оставшаяся релаксация приписывается EDH.Кривые концентрация-ответ на ACh у небеременных мышей (E) Rln + / + и (F) Rln — / — после предварительной обработки артерий (квадрат) L- НАЗВАНИЕ + Индо, (круг) ИМЯ L + Индо + ТРАМ-34, (треугольник) ИМЯ Л + Индо + ТРАМ-34 + апамин. (G) Анализ AUC EDH-опосредованной релаксации и вкладов калиевых каналов с промежуточной (IK Ca ) и малой проводимости (SK Ca ) Ca 2+ -активированных калиевых каналов в вызванную ACh релаксацию в матке артерии небеременных Rln + / + и Rln — / — мышей и (H) изменение максимального расслабления (R max ) ( n = 5–8 на группу ).* P <0,0001 двусторонний дисперсионный анализ по сравнению с контролем; # P <0,05 двусторонний дисперсионный анализ L-NAME по сравнению с L-NAME + Indo; λ P <0,05 двусторонний дисперсионный анализ по отношению к L-NAME + Indo; α P <0,05 двусторонний дисперсионный анализ L-NAME + Indo + TRAM-34 по сравнению с L-NAME + Indo + TRAM-34 + апамин; ∧ P <0,05 на основании однофакторного дисперсионного анализа генотипа.
Таблица 1 . Реактивность маточной артерии у мышей Rln + / + и Rln — / — .
Ингибирование NOSзначительно снижает индуцированное ACh расслабление (R max и AUC, P <0,05) и чувствительность ( P <0,05) в маточных артериях небеременных мышей (Фигуры 3A – D; Таблица 1). Чувствительность и максимальный ответ на ACh не различались у мышей Rln — / — и Rln + / + у мышей L-NAME (Фигуры 3A, B, D; Таблица 1). Блокада продукции простаноидов вызывала дальнейшее торможение релаксации.В присутствии Indo чувствительность к ACh была ниже (в два раза, P = 0,02) у мышей Rln — / — (таблица 1). Расслабление, остающееся в присутствии L-NAME + Indo, приписывается EDH.
Общая AUC для релаксации была значительно меньше в артериях у мышей Rln — / — (рис. 3С). Анализ AUC показал, что вклад NO, сосудорасширяющих простаноидов и EDH в эндотелий-зависимую релаксацию не отличался у мышей Rln + / + и Rln — / — .Изменение максимального расслабления, вызванного L-NAME и Indo, и максимального расслабления, связанного с EDH, существенно не различались между группами (рис. 3D).
Относительный вклад каналов IK Ca и SK Ca в EDH-опосредованную релаксацию был исследован в присутствии L-NAME + Indo только с TRAM-34 или комбинации TRAM-34 + апамин (Фигуры 3E, F ). Ингибирование активности IK Ca с помощью TRAM-34 не изменяет чувствительность к ACh, но значительно снижает максимальное EDH-опосредованное расслабление в артериях как от Rln , + / + ( P = 0.006) и Rln — / — ( P = 0,002) мышей, однако степень восстановления, производимого TRAM-34, не различалась между генотипами (Фигуры 3E – H; Таблица 1). Последующая блокада активности канала SK Ca апамином дополнительно снижает EDH-опосредованную релаксацию (pEC 50 , R max и AUC) (Фигуры 3E – H; Таблица 1). Максимальное расслабление было значительно снижено как для Rln + / + ( P = 0,01), так и для Rln — / — ( P = 0.04) мышей (рис. 3F). Эффект ингибирования SK Ca на максимальное EDH-опосредованное расслабление был больше в маточных артериях у мышей Rln + / + по сравнению с Rln — / — мышей (фигура 3H). Релаксация EDH практически не происходила в присутствии ингибирования каналов IK Ca и SK Ca в маточных артериях от мышей Rln + / + и Rln — / — .
АнализAUC показал, что общая релаксация EDH не различалась у мышей Rln + / + и Rln — / — (фигура 3G).Основной вклад каналов IK Ca не изменился, но вклад каналов SK Ca был значительно ( P <0,05) снижен в артериях мышей Rln — / — (Рисунки 3G, H).
Влияние беременности на эндотелий-зависимую релаксацию
Во время беременности не было значительной разницы в чувствительности маточной артерии, AUC или максимальной релаксации к ACh между беременными Rln — / — и Rln + / + мышами (Рисунки 4A – C; Таблица 1).Анализ AUC показал, что вклад NO, простаноидов, расширяющих сосуды, и EDH в общую эндотелий-зависимую релаксацию не отличался между генотипами. Общий вклад EDH в эндотелий-зависимую релаксацию в маточной артерии был значительно увеличен во время беременности как у Rln + / + ( P = 0,0008), так и у Rln — / — ( P = 0,002) мышей (рисунок 4C по сравнению с рисунком 3C; таблица 1).
Рисунок 4 .Кривые зависимости от концентрации эндотелий-зависимого агониста ацетилхолина (ACh) в основных маточных артериях поздней беременности (A) Rln + / + и (B) Rln — / — мышей после предварительной обработки артерий без (кружок; контроль) или с ингибитором NOS (треугольник) L-NAME или (ромб) L-NAME и ингибитором COX Indo (L-NAME + Indo). (C) Вклад оксида азота (NO), сосудорасширяющих простаноидов (PG) и вызванной эндотелием гиперполяризации (EDH) в индуцированное ACh расслабление у поздних беременных Rln + / + и Rln — / — мышей) и (D) изменение максимальной релаксации (R max ) на ACh после инкубации с L-NAME и L-NAME + Indo, при этом оставшаяся релаксация приписывается EDH.Кривые концентрация-ответ на ACh в магистральных артериях матки на поздних сроках беременности (E) Rln + / + и (F) Rln — / — мышей после предварительной обработки артерий ( квадрат) L-NAME + Indo, (круг) L-NAME + Indo + TRAM-34, (треугольник) L-NAME + Indo + TRAM-34 + apamin. (G) Вклад EDH, промежуточной проводимости (IK Ca ) и низкой проводимости (SK Ca ) Ca 2+ -активированных калиевых каналов в индуцированном ACh расслаблении в основных маточных артериях небеременных Rln + / + и Rln — / — мышей при анализе как AUC и (H) — изменение максимальной релаксации (R max ) ACh после инкубации с TRAM-34 и TRAM- 34 + апамин ( n = 7–9 на группу).* P <0,0001 двусторонний дисперсионный анализ по сравнению с контролем; # P <0,05 двусторонний дисперсионный анализ L-NAME по сравнению с L-NAME + Indo; λ P <0,0001 двусторонний дисперсионный анализ по отношению к L-NAME + Indo; α P <0,05 двусторонний дисперсионный анализ L-NAME + Indo + TRAM-34 по сравнению с L-NAME + Indo + TRAM-34 + апамин; ∧ P <0,05 на основании однофакторного дисперсионного анализа генотипа.
Предварительная инкубация с L-NAME значительно снижала ACh-индуцированную релаксацию (pEC 50 , R max и AUC, P <0.05) в маточных артериях беременных мышей. Эффект L-NAME на расслабление не отличался между артериями мышей Rln — / — и Rln + / + (Фигуры 4A – D; Таблица 1). Последующее воздействие Indo не оказало дальнейшего значительного влияния на чувствительность к ACh, но максимальное расслабление было дополнительно снижено в артериях от Rln + / + ( P = 0,018), но не Rln — / — мышей ( Рисунок 4D).
Во время беременности чувствительность к ACh-вызванной EDH-опосредованной релаксации не различалась у мышей Rln + / + и Rln — / — (Фигуры 4E, F; Таблица 1).Основной вклад каналов IK Ca в EDH-опосредованную релаксацию был значительно ( P <0,05) увеличен, однако роль каналов SK Ca была значительно ( P <0,05) снижена в Rln — / — мышей (Рисунки 4E – H; Таблица 1).
Нарушение BK-опосредованной эндотелий-зависимой релаксации у небеременных мышей с дефицитом релаксина
В то время как ACh вызывал максимальное эндотелий-зависимое расслабление, BK вызывал субмаксимальное расслабление даже при самой высокой концентрации, используемой у небеременных мышей (Фигуры 5A, C; Таблица 1).Несмотря на сильную BK-опосредованную релаксацию в маточных артериях у небеременных мышей Rln + / + (Рисунок 5A; Таблица 1), BK не смог вызвать значительной релаксации в маточных артериях небеременных Rln — / — мышей (Рисунок 5C; Таблица 1). В отличие от ACh, релаксация, вызванная BK, полностью опосредована NO (рис. 5A; таблица 1).
Рисунок 5 . Кривые концентрация-ответ на эндотелий-зависимый агонист брадикинин (ВК) в основных маточных артериях от Rln + / + (A) небеременных и (B) беременных мышей, а также от Rln — / — (C) небеременных и (D) беременных мышей после предварительной обработки артерий без (кружок; контроль) или с ингибитором NOS (треугольник) L-NAME или (ромб) L-NAME и ингибитор ЦОГ Indo (L-NAME + Indo).Кривые концентрация-ответ на эндотелий-независимый агонист нитропруссида натрия (SNP) в основных маточных артериях от (E) небеременных и (F) беременных Rln + / + и Rln — / — мышей ( n = 7–9 на группу).
Во время беременности максимальное расслабление, вызванное BK, не отличалось в маточных артериях от небеременных мышей Rln + / + (Рисунок 5B; Таблица 1). Однако BK-опосредованная релаксация была значительно усилена в артериях у беременных мышей Rln — / — (фиг. 5D), так что максимальное BK-опосредованное расслабление не отличалось от релаксации в артериях из Rln + / + мышей (Фигуры 5B, D; Таблица 1).Большая часть BK-опосредованного расслабления приписывается NO, однако небольшой компонент, связанный с вазодилатирующим простаноидом, появился во время беременности в маточных артериях от Rln + / + и Rln — / — мышей (Рисунки 5B , D; таблица 1).
Эндотелий-независимая релаксация в маточной артерии мышей с дефицитом релаксина
Не было существенной разницы в чувствительности гладких мышц к SNP в маточных артериях у мышей Rln — / — и Rln + / + у небеременных (Рисунок 5E; Таблица 1) и беременных (Рисунок 5F). ; Таблица 1).При адаптации к беременности чувствительность гладких мышц к SNP не изменилась в маточных артериях у мышей Rln + / + (фигура 5F; таблица 1). Однако чувствительность к SNP была значительно ( P = 0,035) увеличена у мышей Rln — / — (рисунок 5F; таблица 1). Максимальное расслабление к SNP было значительно увеличено с беременностью для маточных артерий как от Rln + / + ( P = 0,0003), так и от Rln — / — ( P = 0.0012) мышей (Фигуры 5E, F; Таблица 1).
Чувствительность и максимальный ответ на илопрост не различались в маточных артериях мышей Rln + / + или Rln — / — и не зависели от беременности (Таблица 1).
Дефицит релаксина слабо влияет на экспрессию генов, связанных с гипертонией, на поздних сроках беременности
Для скрининга потенциальных механизмов, регулирующих повышенный миогенный тонус и аберрантную релаксацию маточной артерии у поздних беременных мышей Rln — / — , мы проанализировали 84 представляющих интерес гена с использованием массива qPCR.Удивительно, но дефицит релаксина значительно изменил экспрессию только 8 генов (из 84 проанализированных). Несмотря на его влияние на миогенный тонус, дефицит релаксина не изменяет гены, участвующие в синтезе NO; эндотелиальный NOS (eNOS; Nos3 , фигура 6A; таблица 2), белок, взаимодействующий с NOS ( Nosip ) или транспортный белок NOS ( Nostrin ; таблица 2). Экспрессия рецептора простагландина I 2 ( Ptgir ) продемонстрировала тенденцию к снижению экспрессии у мышей Rln — / — , но не достигла значимости ( P = 0.06; Рисунок 6B; Таблица 2). Также не наблюдалось значительного влияния дефицита релаксина на экспрессию эндотелин-превращающего фермента 1 ( Ece1, P = 0,08; Рисунок 6C; Таблица 2), эндотелина-1 (ET-1, Edn1 ), эндотелина-2. ( End2 ) и рецепторы эндотелина (ET A , Ednra и ET B , Ednrb ; таблица 2).
Рисунок 6 . Количественный ПЦР-анализ (A) эндотелиальных NOS ( Nos3 ), (B) рецептора простагландина I 2 рецептора ( Ptgir ), (C) эндотелин-превращающего фермента 1 ( Ece1 ) (D) никотиновый холинорецептор типа β1 ( Chrnb1 ), (E) , кодирующий циклический нуклеотидно-управляемый канал α4 ( Cnga4 ), (F) инозитол-1,4,5-трифосфатный рецептор-2 (9018 Itpr1 ), (G) инозитол-1,4,5-трифосфатный рецептор-2 ( Itpr2 ) и (H) натриевый беспотенциально закрытый канал типа 1α ( Scnn1a ) в маточной артерии поздно -беременные (•) Rln + / + и (•) Rln — / — мышей ( n = 4–6 на группу).* P <0,05 Непарные t -тесты Стьюдента на основе генотипа.
Таблица 2 . Экспрессия генов в маточных артериях мышей на поздних сроках беременности.
Анализ qPCR также выявил новые гены, на которые влияет дефицит релаксина, в том числе никотиновый холинергический рецептор типа β1 ( Chrnb1 ), кодирующий канал α4, управляемый циклическими нуклеотидами ( Cnga4 ), инозитол 1,4,5-трифосфатный рецептор-2 ( Itpr1 ) и инозитол-1,4,5-трифосфатный рецептор-2 ( Itpr2 ), которые все были значительно активированы в 2 раза или более ( P <0.05, рисунки 6D – H; Таблица 2).
Влияние дефицита релаксина на вес плода и плаценты
Распределение веса плода жизнеспособных плодов мышей Rln — / — было сдвинуто влево (указывает на более низкий вес) с 39% плодов от Rln — / — мышей с массой ниже 10-го. центиль (<732,4 мг) нормального распределения мышей Rln + / + (фигура 7A). Жизнеспособное количество детенышей в помете не изменялось в зависимости от генотипа ( Rln + / + = 7.9 ± 1,6; Rln — / — = 8,8 ± 1,6, рисунок 7B). Исходные средние веса пометов от беременных мышей Rln — / — были значительно снижены по сравнению с мышами Rln + / + , весящими примерно на 10% меньше (фигура 7C; таблица 3; P = 0,001). После корректировки на самок и размер помета оценочные средние предельные значения плодов от беременных мышей Rln — / — все еще были значительно снижены по сравнению с Rln + / + мышей (фигура 7D; таблица 3; P < 0.001). Интересно, что вес плаценты на 17-й день беременности не зависел от генотипа даже после поправки на самок и размер помета (Рисунки 7E, F; Таблица 3).
Рисунок 7. (A) Распределение веса плодов с 17-го дня беременности Rln + / + и Rln — / — самок мышей как% от популяции плода исследования. Вертикальная пунктирная линия представляет 10-й центиль для распределения веса плода при 732,4 мг. (B) Количество жизнеспособных детенышей в помете из Rln + / + и Rln — / — пометов. (C) Необработанный средний вес плода (мг), (D) расчетное предельное среднее значение веса плода (мг), (E) необработанный средний вес плаценты (мг) и (F) расчетное маргинальное среднее веса плаценты (мг) из Rln + / + и Rln — / — пометов. * P <0,05 Непарные t -тесты Стьюдента для необработанных данных, основанные на генотипе или общей линейной модели для оцененных маргинальных средних.
Таблица 3 .Вес плода и плаценты из пометов соответствующего возраста Rln + / + и Rln — / — .
Обсуждение
Это исследование показало, что релаксин является регулятором функции маточной артерии у беременных и не беременных. Важно отметить, что релаксин необходим для нормальной адаптации маточной артерии к беременности, особенно для снижения миогенного тонуса маточной артерии. Чувствительность маточной артерии к агонистам эндотелия была значительно снижена у небеременных мышей Rln — / — , причем различия исчезли во время беременности.Основной вклад каналов K Ca в EDH-опосредованную релаксацию был нарушен у мышей с дефицитом релаксина, и эта особенность сохранялась от отсутствия беременности до беременности. Нарушение регуляции миогенного тонуса маточной артерии во время беременности, вероятно, будет нарушать маточно-плацентарную перфузию и вносить вклад в ограничение роста плода у мышей Rln — / — .
При отсутствии беременности развитие и регуляция миогенного тонуса маточной артерии были сходными у мышей Rln + / + и Rln — / — .Сходные результаты были также получены для мелких почечных артерий у небеременных мышей Rln — / — (Novak et al., 2006). В маточных артериях небеременных животных обоих генотипов NO играет важную роль в регуляции миогенного тонуса. По-видимому, роль сосудорасширяющих простаноидов незначительна, поскольку ингибирование ЦОГ не оказывает значительного влияния на развитие миогенного тонуса. Общий вклад NO и простаноидов, расширяющих сосуды, в регуляцию миогенного тонуса оказался сходным в артериях обоих генотипов.
Подавление развития миогенного тонуса в маточной артерии во время беременности было зарегистрировано у нескольких видов (Veerareddy et al., 2002; Xiao et al., 2010; Hu et al., 2011). При адаптации к беременности мы также обнаружили, что развитие миогенного тонуса было значительно снижено в маточных артериях наших поздних беременных мышей Rln + / + . Хотя NO играет важную роль в регуляции миогенного тонуса, роль простаноидов, предположительно простациклина, была значительно повышена в маточных артериях беременных мышей Rln + / + .Поразительным открытием настоящего исследования является то, что нормальное подавление миогенного тонуса во время беременности не произошло у мышей Rln — / — . Степень развития миогенного тонуса в маточных артериях у беременных мышей Rln — / — была неотличима от таковой у небеременных мышей. Интересно, что это произошло, несмотря на значительное повышение роли NO в регуляции миогенного тонуса в маточных артериях беременных мышей Rln — / — .Напротив, поддержание высокого уровня миогенного тонуса маточной артерии объясняется отсутствием активации простаноидного компонента во время беременности на фоне дефицита релаксина. Эти данные подтверждаются тенденцией к снижению экспрессии мРНК рецептора простациклина. Однако ферменты, участвующие в каскаде простагландинов, ЦОГ-1 и ЦОГ-2, не были затронуты. Кроме того, мы ранее продемонстрировали на беременных мышах Rln — / — , что существует дефицит продукции простаноидов, производных от гладкомышечных вазодилататоров, в брыжеечных артериях (Marshall et al., 2016), которые можно было восстановить с помощью 5-дневной непрерывной инфузии релаксина (Marshall et al., 2017a). Таким образом, сниженная продукция простаноидов-вазодилататоров и / или экспрессия их рецепторов в маточной артерии беременных мышей Rln — / — лежит в основе поддержания высокого уровня миогенного тонуса.
Лечение релаксином небеременных крыс снижает развитие миогенного тонуса в почечных и брыжеечных артериях (Novak et al., 2002) до уровней тонуса, аналогичных тем, которые наблюдаются в этих артериях во время беременности (Gandley et al., 2001). Такое подавление тонуса в артериях небеременных крыс объясняется повышенной биодоступностью NO за счет усиления передачи сигналов эндотелиального и эндотелиального рецепторов ET B и повышенной активности eNOS (Gandley et al., 2001; Novak et al., 2002). Однако в нашей модели дефицита релаксина дефицита роли NO в регуляции миогенного тонуса во время беременности не наблюдалось. Фактически, роль NO была усилена в маточных артериях беременных мышей Rln — / — .Мы не обнаружили различий в экспрессии генов, участвующих в синтезе NO, или генов, связанных с сигнальным путем рецептора ET B . Повышение активности eNOS и / или биодоступности NO, вероятно, лежит в основе усиленной NO-зависимой регуляции миогенного тонуса у беременных мышей Rln — / — и может отражать компенсаторный механизм для противодействия отказу вазодилататорного простаноидного пути.
Наши результаты показали ключевую роль эндогенного релаксина в обеспечении адаптивного снижения миогенного тонуса основной маточной артерии во время беременности.Это снижение миогенного тонуса будет способствовать увеличению перфузии маточно-плацентарного отдела для поддержания здоровой беременности. В самом деле, это подтверждается аналогичными данными для малых почечных артерий, когда беременные крысы в середине беременности, получавшие нейтрализующие релаксин антитела (MCA1), больше не демонстрировали нормального снижения миогенного тонуса, связанного с беременностью (Novak et al., 2001). Кроме того, у беременных крыс, получавших MCA1, не наблюдалось гестационного увеличения сердечного выброса, общей артериальной податливости и снижения системного сосудистого сопротивления, которые происходят во время беременности у здоровых крыс (Debrah et al., 2006). В совокупности текущее исследование и предыдущие результаты других групп подчеркивают важность релаксина как неотъемлемой молекулы, участвующей в адаптации сердечно-сосудистой системы матери к беременности.
Маточные артерии небеременных мышей Rln — / — проявляли эндотелиальную вазодилататорную дисфункцию при стимуляции ACh или BK. ACh высвобождает набор сосудорасширяющих средств, включая NO, EDH и простаноидное вазодилататорное средство, вероятно, простациклин. Чувствительность к ACh была значительно снижена у мышей Rln — / — , хотя максимальная релаксация не различалась между генотипами.Сходным образом, в исследовании самцов мышей Rln — / — брыжеечные артерии имели пониженную чувствительность к ACh-опосредованной релаксации (Leo et al., 2014a). Нарушение у мужчин объясняется активацией простаноидного вазоконстрикторного пути, однако у нас нет доказательств того, что нарушение у самок Rln — / — вызвано этим. Наше исследование также коррелирует с исследованиями лечения релаксином (Leo et al., 2014b, 2017; Ng et al., 2016). После блокады синтеза NO не было различий в чувствительности к ACh между генотипами, однако после ингибирования продукции простаноидов чувствительность к ACh и, таким образом, EDH-опосредованная релаксация ухудшалась.Дальнейшее исследование роли каналов K Ca , участвующих в EDH-опосредованной релаксации, показало, что вклад каналов SK Ca был уменьшен в маточных артериях небеременных мышей Rln — / — . Нарушение экспрессии и / или активности канала SK Ca в артериях было зарегистрировано при различных сердечно-сосудистых заболеваниях (Félétou, 2016).
В маточных артериях общее эндотелий-зависимое расслабление, вызванное BK, было лишь частью того, что вызвано ACh.В то время как ACh вызывал высвобождение различных сосудорасширяющих средств из эндотелия маточных артерий мышей, как было опубликовано ранее (Cooke and Davidge, 2003), у небеременных мышей BK вызывал релаксацию, которая полностью опосредована NO. Интересно, что BK-опосредованная релаксация практически отсутствовала в артериях небеременных мышей Rln — / — . Отсутствие ответа на BK, вероятно, также усугублялось нарушением чувствительности гладких мышц маточной артерии к NO у небеременных мышей Rln — / — .У самцов крыс лечение релаксином (острая внутривенная инъекция или 72-часовая непрерывная инфузия) избирательно увеличивало BK-опосредованное расслабление в брыжеечной артерии за счет усиления продукции простациклина (Leo et al., 2014b, 2016b), тогда как 48-часовая инфузия релаксина усиливала BK -опосредованная релаксация через путь NO (Leo et al., 2016b). Предполагается, что релаксин сигнализирует тщательно продуманным гетеродимерам, состоящим из рецептора релаксина и рецепторов BK (RXFP1-B 2 R), чтобы влиять на дилатацию (Leo et al., 2016a).Из-за тканевых ограничений маточной артерии небеременных мышей мы не смогли дополнительно исследовать, повлиял ли дефицит релаксина на эти гетеродимеры или гены, связанные с ACh-опосредованной релаксацией.
Различия в чувствительности к ACh и ответной реакции на BK, наблюдаемые между маточными артериями мышей Rln + / + и Rln — / — , исчезли с беременностью. Вазодилататорная функция эндотелия усиливается во время беременности с повышенной активностью путей NO, простациклина и EDH под влиянием стероидных гормонов, таких как эстроген (Weiner et al., 1994; Vagnoni et al., 1998; Чжан и др., 2001; Egan et al., 2004; Бут и др., 2008; Гокина и др., 2010). Несмотря на то, что чувствительность ACh к EDH-опосредованной релаксации не различалась во время беременности между генотипами, оставалась основная дисрегуляция вкладов каналов IK Ca и SK Ca в артериях мышей с дефицитом релаксина. Роль каналов IK Ca была повышена, в то время как роль каналов SK Ca была снижена в маточных артериях мышей Rln — / — .Ранее было продемонстрировано, что релаксин стимулирует активность миометриальных кальций-активируемых калиевых каналов (Meera et al., 1995) и усиливает активность канала IK Ca в брыжеечных артериях крыс и паренхиматозных артериолах головного мозга (Leo et al., 2016a). Однако потенциальные эффекты релаксина на эти активируемые кальцием калиевые каналы во время беременности в маточной артерии остаются неизученными. Обусловлено ли несоответствие вкладов каналов IK Ca и SK Ca между Rln — / — и Rln + / + различиями в экспрессии каналов или механизмах передачи сигналов (Гокина и др., 2010; Félétou, 2016) необходимо будет изучить в будущих исследованиях.
Чтобы максимизировать экспериментальный результат для ограниченной доступной ткани, подход к анализу массивов кПЦР оценивал, как дефицит релаксина влияет на экспрессию 84 различных генов в основной маточной артерии мышей на поздних сроках беременности (Moradipoor et al., 2016). Это позволило провести широкий скрининг генов, связанных с сердечно-сосудистой системой, чего нельзя было достичь с помощью других количественных методов. Тем не менее, мы наблюдали тенденции в экспрессии генов, которые не достигли значимости, и для этих анализов была бы полезна дополнительная ткань, если бы она была доступна.Из 8 генов, значительно модулируемых дефицитом релаксина, большинство были новыми и неожиданными. Дефицит релаксина не оказывает значительного влияния на гены, участвующие в синтезе NO или PGI 2 , но усиливает экспрессию мРНК рецептора ACh Chrnb1 (Albuquerque et al., 2009). Поскольку маточные артерии мышей Rln — / — больше не демонстрируют сниженной чувствительности к ACh на поздних сроках беременности в отсутствие ингибиторов, это может быть связано с увеличением экспрессии рецепторов ACh.Из новых генов, на которые влияет дефицит релаксина Cnga3 , субъединица канала, управляемого циклическими нуклеотидами, участвует в передаче сигнала и может находиться под влиянием ионов кальция (Dai et al., 2014), что делает эту находку интересной. Фактор гипоксии α ( Hif1 α), субъединица фактора транскрипции, действующего на гипоксию (Benita et al., 2009), подавлялся в маточной артерии у поздних беременных мышей Rln — / — . Остается выяснить, приводят ли и в какой степени эти изменения в экспрессии генов к измененному фенотипу основной маточной артерии.
Таким образом, эндогенный релаксин играет обязательную роль в нормальном, связанном с беременностью подавлении миогенного тонуса в маточной артерии. Во время беременности эндогенный релаксин критически активизирует модуляцию миогенного тонуса, опосредованную простаноидами, для поддержки маточно-плацентарной перфузии и роста плода.
Авторские взносы
LP и MT разработали исследовательский проект. SM, SS, MJ, KO и MT проводили исследования. Компания SM произвела разведение мышей, проверила течку, установила беременность, наблюдала за всеми мышами и завершила сбор всех тканей.Рукопись написали С.М., М.Т. и С.С. SM, SS, MJ и MT проанализировали данные и выполнили статистический анализ. Все авторы прочитали и одобрили окончательную рукопись.
Финансирование
Автор (ы) раскрыл получение следующей финансовой поддержки для исследования, авторства и / или публикации этой статьи: эта работа была поддержана грантом проекта Австралийского национального совета по здравоохранению и медицинским исследованиям (LP1064845) и Университета Мельбурна. Грант раннего научного сотрудника SS.SM и MJ получили австралийские награды для аспирантов.
Заявление о конфликте интересов
Авторы сообщают, что LP была оплачиваемым консультантом Novartis Pharma AG с 2012 по 2015 годы.
Другие авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят г-жу Таню Лонг и г-на Даррена Чиполлу (Университет Мельбурна) за помощь в поддержании колонии мышей, а также доктора Марка Дилворта (Университет Манчестера) и его исследовательскую группу за их помощь в представлении данных о весе плода в виде нормального распределения. кривые.Авторы также благодарят доктора Миранду Дэвис-Так (Центр Ричи, Гудзоновский институт медицинских исследований, Университет Монаша) за ее неоценимую помощь в статистическом анализе веса плода и плаценты.
Список литературы
Альбукерке, Э. X., Перейра, Э. Ф., Алкондон, М., и Роджерс, С. В. (2009). Никотиновые ацетилхолиновые рецепторы млекопитающих: от структуры к функции. Physiol. Rev. 89, 73–120. DOI: 10.1152 / Physrev.00015.2008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бенита, Ю., Кикучи, Х., Смит, А. Д., Чжан, М. К., Чунг, Д. К., и Ксавьер, Р. Дж. (2009). Подход интегративной геномики определяет гены-мишени фактора-1, индуцируемого гипоксией (HIF-1), которые формируют основной ответ на гипоксию. Nucleic Acids Res. 37, 4587–4602. DOI: 10.1093 / nar / gkp425
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бут, Э. А., Флинт, Р. Р., Лукас, К. Л., Книттель, А. К., и Луччези, Б. Р. (2008). Эстроген защищает сердце от ишемии-реперфузии через PGI2, производный от COX-2. J. Cardiovasc. Pharmacol. 52, 228–235. DOI: 10.1097 / FJC.0b013e3181824d59
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Конрад, К. П., и Дэвисон, Дж. М. (2014). Почечное кровообращение при нормальной беременности и преэклампсии: есть ли место релаксину? Am. J. Physiol. Почечный 306, F1121 – F1135. DOI: 10.1152 / ajprenal.00042.2014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кук, К.-Л., и Дэвидж, С.Т. (2003). Вызванные беременностью изменения сосудистой функции брыжеечных и маточных артерий мышей. Biol. Репрод. 68, 1072–1077. DOI: 10.1095 / биолрепрод.102.009886
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коркоран, Дж. Дж., Николсон, К., Суини, М., Чарнок, Дж. К., Робсон, С. С., Вествуд, М., и другие. (2014). Человеческие маточные и плацентарные артерии проявляют тканеспецифические острые реакции на 17-бета-эстрадиол и агонисты рецепторов эстрогена. Mol. Гул. Репрод. 20, 433–441. DOI: 10,1093 / мольхр / gat095
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дай, Г., Шерпа, Т., и Варнум, М. Д. (2014). Альтернативный сплайсинг регулирует чувствительность конусных циклических нуклеотид-управляемых (CNG) каналов к регуляции фосфоинозитидами. J. Biol. Chem. 289, 13680–13690. DOI: 10.1074 / jbc.M114.562272
CrossRef Полный текст | Google Scholar
Дебра, Д. О., Новак, Дж., Мэтьюз, Дж.Э., Рамирес Р. Дж., Шрофф С. Г. и Конрад К. П. (2006). Релаксин необходим для системного расширения сосудов и повышения общей эластичности артерий во время ранней беременности у крыс в сознании. Эндокринология 147, 5126–5131. DOI: 10.1210 / en.2006-0567
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дилворт, М. Р., Кусински, Л. К., Бейкер, Б. К., Реншалл, Л. Дж., Гринвуд, С. Л., Сибли, К. П. и др. (2011). Определение ограничения роста плода у мышей: стандартизованный и клинически значимый подход. Плацента 32, 914–916. DOI: 10.1016 / j.placenta.2011.08.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Иган, К. М., Лоусон, Дж. А., Фрис, С., Коллер, Б., Рейдер, Д. Дж., Смит, Э. М. и др. (2004). Простациклин, производный от ЦОГ-2, обеспечивает атерозащиту у самок мышей. Наука 306, 1954–1957. DOI: 10.1126 / science.1103333
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феррейра В. М., Гомеш Т. С., Рейс Л.A., Ferreira, A. T., Razvickas, C. V., Schor, N., et al. (2009). Рецептор-индуцированная дилатация в системной и внутрипочечной адаптации крыс к беременности. PLoS ONE 4: e4845. DOI: 10.1371 / journal.pone.0004845
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гэндли, Р. Э., Конрад, К. П., и Маклафлин, М. К. (2001). Эндотелин и оксид азота опосредуют снижение миогенной реактивности мелких почечных артерий беременных крыс. Am. J. Physiol. Regul.Интегр. Комп. Physiol. 280, R1 – R7. DOI: 10.1152 / ajpregu.2001.280.1.R1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гокина Н. И., Кузина О. Ю., Вэнс А. М. (2010). Усиленная передача сигналов EDHF в маточно-плацентарной сосудистой сети крыс на поздних сроках беременности. Am. J. Physiol. Heart Circ. Physiol. 299, h2642 – h2652. DOI: 10.1152 / ajpheart.00227.2010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гуи, Дж. Х., Ричардсон, М.L., Jelinic, M., Girling, J.E., Wlodek, M.E., Tare, M., et al. (2013). Повышенная жесткость маточной артерии у старых беременных мышей с мутантным релаксином устраняется обработкой экзогенным релаксином. Biol. Репрод. 89, 1–11. DOI: 10.1095 / биолрепрод.113.108118
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ху, Х.К., Сяо, Д., Чжу, Р., Хуанг, X., Янг, С., Уилсон, С., и др. (2011). Беременность активирует активность канала K (+) , активированного Ca (2+) с высокой проводимостью, и снижает миогенный тонус в маточных артериях. Гипертония 58, 1132–1139. DOI: 10.1161 / HYPERTENSIONAHA.111.179952
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Jelinic, M., Leo, C.-H., Uiterweer, E. D. P., Sandow, S. L., Gooi, J. H., Wlodek, M. E., et al. (2014). Локализация рецепторов релаксина в артериях и венах, а также регионально-специфическое повышение податливости и опосредованной брадикинином релаксации после лечения in vivo серелаксином. FASEB J. 28, 275–287. DOI: 10.1096 / fj.13-233429
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ланг, У., Бейкер, Р. С., Брамс, Г., Зигмунт, М., Кунзель, В., и Кларк, К. Э. (2003). Маточный кровоток — определяющий фактор роста плода. Eur. J. Obstet. Гинеколь. Репрод. Биол. 22, S55 – S61. DOI: 10.1016 / S0301-2115 (03) 00173-8
CrossRef Полный текст | Google Scholar
Лео, К. Х., Елинич, М., Гуи, Дж. Х., Тэр, М., и Парри, Л. Дж. (2014a). Вазоактивная роль эндогенного релаксина в брыжеечных артериях самцов мышей. PLoS ONE 9: e107382. DOI: 10.1371 / journal.pone.0107382
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Leo, C.H., Jelinic, M., Ng, H.H., Marshall, S.A., Novak, J., Tare, M., et al. (2017). Сосудистое действие релаксина: оксид азота и не только. Br. J. Pharmacol. 174, 1002–1014. DOI: 10.1111 / bph.13614
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лео, К. Х., Елинич, М., Нг, Х. Х., Тэр, М., и Парри, Л.J. (2016a). Серелаксин: новое лекарство от сосудистых заболеваний. Trends Pharmacol. Sci. 37, 498–507. DOI: 10.1016 / j.tips.2016.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лео, К. Х., Елинич, М., Нг, Х. Х., Тэр, М., и Парри, Л. Дж. (2016b). Зависящая от времени активация путей простациклина и оксида азота при непрерывном внутривенном введении. инфузия серелаксина (рекомбинантный человеческий релаксин h3). Br. J. Pharmacol. 173, 1005–1017. DOI: 10.1111 / бф. 13404
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лео, К. Х., Елинич, М., Паркингтон, Х. К., Тэр, М., и Парри, Л. Дж. (2014b). Острая внутривенная инъекция серелаксина (рекомбинантного человеческого релаксина-2) вызывает быструю и стойкую опосредованную брадикинином вазорелаксацию. J. Am. Сердце доц. 3, 1–15. DOI: 10.1161 / JAHA.113.000493
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мандала, М., и Осол, Г. (2012).Физиологическое ремоделирование маточного кровообращения у матери во время беременности. Basic Clin. Pharmacol. Toxicol. 110, 12–18. DOI: 10.1111 / j.1742-7843.2011.00793.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маршалл, С. А., Лео, К. Х., Гирлинг, Дж. Э., Тэр, М., Борода, С., Ханнан, Н. Дж. И др. (2017a). Лечение релаксином снижает вазоконстрикцию, вызванную ангиотензином II, во время беременности и защищает от эндотелиальной дисфункции. Biol. Репрод. 96, 895–906. DOI: 10.1093 / biolre / iox023
CrossRef Полный текст | Google Scholar
Маршалл, С. А., Лео, К. Х., Сенадира, С. Н., Гирлинг, Дж. Э., Тэр, М., и Парри, Л. Дж. (2016). Дефицит релаксина ослабляет индуцированную беременностью адаптацию брыжеечной артерии к ангиотензину II у мышей. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 310, R847 – R857. DOI: 10.1152 / ajpregu.00506.2015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маршалл, С.A., O’Sullivan, K., Ng, H.H., Bathgate, R.A.D., Parry, L.J., Akhter Hossain, M., et al. (2017b). B7-33 воспроизводит вазопротекторные функции человеческого релаксина-2 (серелаксина). Eur. J. Pharmacol. 807, 190–197. DOI: 10.1016 / j.ejphar.2017.05.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мира, П., Анвер, К., Монга, М., Оберти, К., Стефани, Э., Торо, Л. и др. (1995). Релаксин стимулирует активность кальций-активируемых калиевых каналов миометрия через протеинкиназу А. Am. J. Physiol. 269 (2, часть 1), C312 – C317. DOI: 10.1152 / ajpcell.1995.269.2.C312
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мейер, М. К., Брайден, Дж. Э. и Маклафлин, М. К. (1993). Характеристики гладких мышц сосудов в кровообращении материнского сопротивления во время беременности у крыс. Am. J. Obstet. Гинеколь. 169, 1510–1516. DOI: 10.1016 / 0002-9378 (93)
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Морадипур, С., Исмаил, П., Этемад, А., Ван Сулейман, В. А., и Ахмадло, С. (2016). Профилирование экспрессии генов, связанных с биологией эндотелиальных клеток, у пациентов с диабетом 2 типа и пациентов с преддиабетом. Biomed Res. Int. 2016: 1845638. DOI: 10.1155 / 2016/1845638
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нг, Х. Х., Лео, К. Х. и Парри, Л. Дж. (2016). Серелаксин (рекомбинантный человеческий релаксин-2) предотвращает эндотелиальную дисфункцию, вызванную высоким уровнем глюкозы, за счет улучшения продукции простациклина в аорте мыши. Pharmacol. Res. 107, 220–228. DOI: 10.1016 / j.phrs.2016.03.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ни, Ю., Мейер, М., и Осол, Г. (1997). Беременность увеличивает опосредованную оксидом азота вазодилатацию в маточных артериях крыс. Am. J. Obstet. Гинеколь. 176, 856–864. DOI: 10.1016 / S0002-9378 (97) 70611-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Новак, Дж., Дэниэлсон, Л. А., Керчнер, Л. Дж., Шервуд, О.Д., Рамирес, Р. Дж., Моалли, П. А. и др. (2001). Релаксин необходим для расширения почечных сосудов во время беременности у крыс в сознании. J. Clin. Вкладывать деньги. 107, 1469–1475. DOI: 10.1172 / JCI11975
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Новак, Дж., Парри, Л. Дж., Мэтьюз, Дж. Э., Керчнер, Л. Дж., Индонива, К., Хэнли-Янез, К., и др. (2006). Доказательства локальной экспрессии и функции рецептора лиганда релаксина в артериях. FASEB J. 20, 2352–2352.DOI: 10.1096 / fj.06-6263com
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Новак Дж., Рамирес Р. Дж. Дж., Гэндли Р. Э., Шервуд О. Д. и Конрад К. П. (2002). Миогенная реактивность снижена в мелких почечных артериях, выделенных от крыс, получавших релаксин. Am. J. Physiol. Regul. Интегр. Комп. Physiol. 283, R349 – R355. DOI: 10.1152 / ajpregu.00635.2001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шервуд, О. Д., Црнекович, В.Э., Гордон У. Л. и Резерфорд Дж. Э. (1980). Радиоиммуноанализ релаксина на протяжении всей беременности и во время родов у крыс. Эндокринология 107, 691–698. DOI: 10.1210 / эндо-107-3-691
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит, М. К., Мердок, А. П., Дэниэлсон, Л. А., Конрад, К. П., и Дэвисон, Дж. М. (2006). Релаксин играет роль в установлении почечной реакции во время беременности. Fertil. Стерил. 86, 253–255. DOI: 10.1016 / j.fertnstert.2005.11.070
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стюарт, Д. Р., Сельникер, А. К., Тейлор, К. А., Краган, Дж. Р., Оверстрит, Дж. У. и Ласли, Б. Л. (1990). Релаксин в периимплантационном периоде. J. Clin. Эндокринол. Метаб. 70, 1771–1773. DOI: 10.1210 / jcem-70-6-1771
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тэр, М., Эммет, С. Дж., Коулман, Х. А., Скордилис, К., Эйлз, Д. У., Морли, Р., и другие. (2011). Недостаточность витамина D связана с нарушением функции эндотелия и гладких мышц сосудов и гипертонией у молодых крыс. J. Physiol. 589 (Pt 19), 4777–4786. DOI: 10.1113 / jphysiol.2011.214726
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ваньони, К. Э., Шоу, К. Э., Фернеттон, Т. М., Меглин, Б. М., Берд, И. М., и Магнесс, Р. Р. (1998). Производство эндотелиальных вазодилататоров маточными и системными артериями. III. Влияние яичников и эстрогенов на NO-синтазу. Am. J. Physiol. 275 (5 Pt 2), h2845 – h2856. DOI: 10.1152 / ajpheart.1998.275.5.h2845
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Veerareddy, S., Cooke, C.-L. М., Бейкер П. Н. и Дэвидж С. Т. (2002). Сосудистая адаптация к беременности у мышей: влияние на миогенный тонус. Am. J. Physiol. Heart Circ. Physiol. 283, h3226 – h3233. DOI: 10.1152 / ajpheart.00593.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vodstrcil, L.A., Tare, M., Novak, J., Dragomir, N., Ramirez, R.J., Wlodek, M.E., et al. (2012). Релаксин обеспечивает эластичность маточных артерий во время беременности и увеличивает маточный кровоток. FASEB J. 26, 4035–4044. DOI: 10.1096 / fj.12-210567
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Weiner, C.P., Lizasoain, I., Baylis, S.A., Knowles, R.G., Charles, I.G., и Moncada, S. (1994). Индукция кальций-зависимых синтаз оксида азота половыми гормонами. Proc.Natl. Акад. Sci. США 91, 5212–5216. DOI: 10.1073 / pnas.91.11.5212
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уизерс, С. Б., Таггарт, М. Дж., Бейкер, П., и Остин, К. (2009). Ответы изолированных маточных артерий крыс под давлением на изменения давления: эффекты предварительного сужения, эндотелия и беременности. Плацента 30, 529–535. DOI: 10.1016 / j.placenta.2009.03.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сяо, Д., Хуанг, X., Ян, С., Лонго, Л. Д., и Чжан, Л. (2010). Беременность подавляет полимеризацию актина и зависимый от давления миогенный тонус в маточных артериях овцы. Гипертония 56, 1009–1015. DOI: 10.1161 / HYPERTENSIONAHA.110.159137
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан Ю., Стюарт К. Г. и Дэвидж С. Т. (2001). Эндогенный эстроген опосредует сосудистую реактивность и растяжимость брыжеечных артерий беременных крыс. Am.J. Physiol. Heart Circ. Physiol. 280, H956 – H961. DOI: 10.1152 / ajpheart.2001.280.3.H956
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhao, L., Roche, P.J., Gunnersen, J.M., Hammond, V.E., Tregear, G.W., и Wintour, E.M. (1999). Мыши без функционального гена релаксина не могут давать молоко своим детенышам. Эндокринология 140, 445–453. DOI: 10.1210 / endo.140.1.6404
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Разрыв матки.Лечение беременности и разрыва матки.
Полный разрыв матки во время беременности — это катастрофическое событие, при котором образуется разрыв на всю толщину, открывающий матку непосредственно в брюшную полость. Это требует быстрого хирургического вмешательства для защиты материнских и младенческих исходов.
Чаще всего возникает во время родов; однако рубцы на матке после более раннего кесарева сечения могут разорваться в третьем триместре до того, как произойдут схватки.
Классификация
- Под оккультным или неполным разрывом понимается хирургический рубец, который отделяется, но висцеральная брюшина остается нетронутой.Обычно оно протекает бессимптомно и не требует экстренного хирургического вмешательства.
- Полный разрыв может быть:
- Травматический :
- Дорожно-транспортное происшествие.
- Неправильное применение окситоцина.
- Плохо проведенная попытка оперативных родов через естественные родовые пути (как правило, удаление тазового предлежания с неполностью расширенной шейкой матки).
- (Оперативная гистероскопия у небеременной женщины).
- Самопроизвольно :
- Большинство пациентов перенесли кесарево сечение или травму в анамнезе, которая могла привести к необратимым повреждениям [1] .
- Пациенты могут не иметь в анамнезе хирургических вмешательств, но у них может быть ослабленная матка из-за множественности, особенно если у них есть старый боковой разрыв шейки матки.
Эпидемиология
Заболеваемость
Разрыв матки происходит крайне редко — согласно одному исследованию из Нидерландов, частота составляет от 0,7 до 5,1 на 10 000 родов в матке без рубцов и рубцов, соответственно [2] . После предыдущего кесарева сечения заболеваемость увеличивается до 22-74 на 10 000 родов, если предпринимаются попытки вагинальных родов после кесарева сечения (VBAC).
По данным систематического обзора разрывов матки во всем мире Всемирной организации здравоохранения (ВОЗ), средний показатель заболеваемости составил 5,3 на 10 000 рождений [3] . Если принять во внимание только страны с высоким уровнем дохода, средняя частота встречаемости составила около 3 на 10 000 родов.
Факторы риска
[4]- 87% случаев приходится на женщин, перенесших кесарево сечение в прошлом:
- Классические вертикальные и Т-образные разрезы имеют более высокий риск более позднего разрыва матки, чем стандартные современные минимальные поперечный подход.
- Интервал между родами менее 18–24 месяцев увеличивает риск [5] .
- Риск, по-видимому, выше при сроке беременности более 40 недель.
- Предыдущие операции на матке (включая миомэктомию, выскабливание, искусственный аборт, удаление плаценты вручную). В 11,5% случаев рубец на матке отсутствует.
- Аномалии матки — например, неразвитый рог матки.
- Травма — например, дорожно-транспортное происшествие.
- Использование ротационных щипцов.
- Затрудненные роды.
- Индукция родов — простагландины следует применять с осторожностью во время пробных родов.
- Разрыв шейки матки.
- Медикаментозное прерывание беременности после 16 недель беременности.
- Плацента percreta или increta.
- Hydramnios.
- Макросомия и аномалия плода — например, гидроцефалия.
- Непредставление (бровь или лицо).
- Многоплодная беременность.
- Хориокарцинома.
Другие процедуры с высоким риском разрыва матки включают внутреннюю подалическую версию и удаление, деструктивные операции и маневры для облегчения дистоции плеча.
Presentation
Лечение разрыва матки зависит от своевременного обнаружения и диагностики. Классические признаки (внезапная рвущая боль в матке, вагинальное кровотечение, прекращение сокращений матки, регресс плода) оказались ненадежными и часто отсутствуют, но любое из следующих признаков должно вызывать подозрение:
- Отклонения от нормы кардиотокографии (КТГ), особенно брадикардия плода [5] .
- Сильная боль в животе, переходящая в постоянную между схватками.
- Боль в груди или кончике плеча и внезапная одышка.
- Рубцовая боль и болезненность.
- Аномальное вагинальное кровотечение или макрогематурия.
- Прекращение ранее эффективных сокращений матки.
- Материнская тахикардия, гипотензия или шок.
- Удаление представляющей части. Пальпация живота может выявить очевидные части плода, поскольку плод частично или полностью выходит из матки в брюшную полость с высоким риском смерти во время родов.
Если есть подозрение на разрыв матки, лапаротомия может потребоваться даже после успешных родов через естественные родовые пути, чтобы оценить повреждение и остановить кровотечение.
Исследования
- Ультразвук можно использовать для диагностики разрыва до родов, когда он может показать аномальное положение плода, гемоперитонеум или отсутствие или тонкую стенку матки. Ультразвук анализируется как инструмент для прогнозирования разрыва матки. Французское исследование предполагает, что толщина стенки матки более 4.5 мм имеет отрицательную прогностическую ценность 100%, но, к сожалению, положительная прогностическая ценность толщины менее 3,5 мм является плохой и составляет всего 11,8% [5] .
- Катетеры для внутриматочного давления иногда используются, но могут не показать потери маточного тонуса или сократительной способности после разрыва матки.
Ведение
Первоначальное лечение такое же, как и при других причинах острого дистресса плода — срочные хирургические роды.
- Реанимация при необходимости.
- Ремонт матки по возможности; гистерэктомия может быть показана, если кровотечение не проходит — полное или частичное, в зависимости от места разрыва и состояния пациента.
- Нет убедительных доказательств относительно того, какой тип нити, узла или последовательности наложения швов более благоприятен для снижения риска разрыва матки после VBAC или гистеротомии после миомэктомии [6] .
- В случаях бокового разрыва нижнего сегмента матки и маточной артерии, когда кровотечение и гематома закрывают операционное поле, может потребоваться перевязка ипсилатеральной гипогастральной артерии для остановки кровотечения.
- Если матка восстановлена, важно отметить, что повторный разрыв происходит примерно в 20% случаев.
Во всех случаях оперативных родов, особенно при наличии факторов риска разрыва матки, требуется тщательное обследование матки и родовых путей.
Осложнения
Прогноз
[5]- 6,2% разрывов матки связаны с перинатальной (младенческой) смертью.
- 14-33% женщин с разрывом матки нуждаются в экстренной гистерэктомии.
- В голландском общенациональном исследовании не было зарегистрировано случаев материнской смертности из-за разрыва матки, связанной с беременностью, но перинатальная смерть (внутриутробная) произошла у 8,7% [2] .
Профилактика
К сожалению, разрыв матки нельзя адекватно спрогнозировать для женщин, желающих испытать роды после предыдущего кесарева сечения [7] . Врачи должны изучить историю болезни на предмет факторов риска и проконсультироваться относительно ее относительных рисков, преимуществ, альтернатив и вероятности успеха.Женщины должны быть проинформированы о том, что плановая VBAC связана с риском разрыва матки примерно 1 из 200 (0,5%) [8] .
Обычно совместная помощь акушера подходит любой женщине, перенесшей кесарево сечение.
Несколько обстоятельств (предшествующий классический или Т-образный разрез и отсутствие средств для экстренного кесарева сечения) исключают возможность проведения пробных родов. Однако в большинстве случаев руководство Национального института здравоохранения и повышения квалификации (NICE) рекомендует принимать во внимание выбор способа родов после предыдущего кесарева сечения. [9] :
- Материнские предпочтения и приоритеты.
- Общее обсуждение общих рисков и преимуществ повторного кесарева сечения по сравнению с VBAC, включая риск незапланированного кесарева сечения.
- Риск разрыва матки для всех женщин, перенесших кесарево сечение, составляет 3 на 1000. Риск пробных родов составляет 4,7 / 1000, а в случае планового повторного кесарева сечения — 0,26 на 1000 [5] .
- Женщин, перенесших до четырех операций кесарева сечения, следует сообщить, что, хотя риск разрыва матки выше при испытании VBAC, он все еще остается редким.Частота разрыва матки у женщин, перенесших более одного кесарева сечения, не выше, чем у женщин, которым было выполнено только одно, хотя частота гистерэктомии и потребность в переливании крови выше [10] .
- 6% разрывов матки связаны с перинатальной смертью. Риск смерти во время родов невелик при плановом VBAC (10 на 10 000), но выше, чем при плановом повторном кесаревом сечении (1 на 10 000). Влияние запланированных вагинальных родов или повторного кесарева сечения на церебральный паралич остается неопределенным.
- Женщинам, перенесшим ранее кесарево сечение, но также родившимся через естественные родовые пути, можно сообщить, что они с большей вероятностью доберутся до вагинальных родов, чем женщины, у которых было только кесарево сечение.
Тем, кто выбирает пробные роды, следует предложить постоянный электронный мониторинг плода во время родов и уход во время родов в отделении, где есть немедленный доступ к экстренному кесареву сечению и службе переливания крови на месте [11] .
Индукция родов
[12]- В руководстве NICE говорится, что женщинам, перенесшим ранее кесарево сечение, может быть предложено индукция родов, но им следует знать, что риск разрыва матки увеличивается в два-три раза, а риск необходимости экстренного кесарева сечения составляет около 1.В 5 раз больше [8] .
- Когда индуцируется запланированная VBAC, риск разрыва матки выше при использовании простагландина, чем при схеме, не основанной на простагландинах: в норвежском обсервационном исследовании с участием почти 19000 женщин риск был в 12,6 раза выше после индукции простагландина, чем при введении простагландина. если индукция была механической или роды спонтанные [13] .
- При увеличении запланированного VBAC доза окситоцина должна быть титрована так, чтобы частота сокращений составляла не более 4 за 10 минут.Исследования подтверждают максимальную дозу окситоцина 20 мЕд / мин в испытаниях родов, чтобы избежать неприемлемо высокого (в 4 раза большего) риска разрыва матки [14] .
- Решения относительно индукции и увеличения плановой VBAC должны приниматься женщиной и акушером-консультантом.
| ||
Послеродовое кровотечение во время первой беременности не влияет на будущую фертильность, как показывают исследования — ScienceDaily
Первые беременности, осложненные послеродовым кровотечением (ПРК), не оказывают пагубного влияния на фертильность в будущем, но женщины, которым было проведено кесарево сечение во время ПРК, с меньшей вероятностью зачать ребенка, считает новое исследование, опубликованное 23 января в BJOG: Международный журнал акушерства и гинекологии .
В Великобритании наблюдается рост общей частоты послеродовых кровотечений (при кровопотере> 500 мл) из-за увеличения материнских факторов риска и количества выполненных кесарева сечения. Женщины, перенесшие кесарево сечение, чаще страдают ПРК, чем роды через естественные родовые пути (59% против 21%).
Это исследование, проводившееся в Абердинском родильном доме в Шотландии в течение 20 лет (1986–2005) с использованием информации из Абердинского банка данных по беременности и родам и новорожденным, изучило 34 334 первых беременности и обнаружило, что у 10% были ПРК.
В документе указывается, что возраст матери, высокие показатели ИМТ и курение являются факторами риска, повышающими вероятность возникновения ПРК.
После первой беременности за женщинами наблюдали не менее пяти лет с целью выявления второй беременности. Затем женщин, перенесших ПРК во время первой беременности, сравнивали с женщинами, у которых этого не было.
Исследователи обнаружили, что не было значительных различий между теми, у кого было ПРК, и теми, у кого не было ПРК, в отношении доли женщин, которые забеременели второй беременностью, во временном интервале между беременностями или при раннем / позднем прерывании беременности.
Однако способ родоразрешения у женщин, первоначально перенесших ПРК, был значительным фактором вероятности второй беременности. Из женщин, которым первоначально было выполнено кесарево сечение, осложнившееся ПРК, 41,5% не забеременели вторую беременность по сравнению с 36,8% женщин, перенесших кесарево сечение, не осложнившееся ПРК.
В документе также было обнаружено, что у женщин, которые первоначально подвергались воздействию ПРК, наблюдалась высокая частота рецидивов — 2 года.Вероятность развития ПРК во время второй беременности в 9 раз выше, чем у тех, у кого не было первоначального контакта (18% против 6,9%).
Гейл Фуллертон из родильного дома Абердина, соавтор исследования, сказала:
«Хотя ПРК при первой беременности увеличивает риск рецидива при последующих беременностях, это не должно быть поводом для беспокойства в отношении будущей фертильности.
«Женщины, участвовавшие в нашем исследовании, не показали отрицательного влияния на вероятность или сроки будущих беременностей после начального осложнения послеродовых кровотечений.
«Тем не менее, очевидно, что необходимо провести дополнительные исследования, чтобы выяснить, почему наблюдается значительное снижение числа последующих беременностей после послеродовых кровотечений во время первых родов с помощью кесарева сечения».
Джон Торп, BJOG Заместитель главного редактора, добавил: «Хотя ПРК остается основной причиной материнской заболеваемости и смертности во всем мире, за последнее десятилетие в акушерской практике в Великобритании произошли более существенные изменения. к ведению и лечению, что приводит к снижению частоты неблагоприятных исходов, таких как гистерэктомия.
«ПРК — это очень травмирующий опыт для женщин, и это исследование обнадеживает своими выводами о том, что общего сокращения числа возвращающихся для второй беременности после начального осложнения ПРК не наблюдается.
«Любая женщина, которая испытывает беспокойство после ПРК, должна проконсультироваться со своим акушером о способах родоразрешения и ведении любых последующих беременностей».
История Источник:
Материалы предоставлены Wiley . Примечание. Содержимое можно редактировать по стилю и длине.
Послеродовое кровотечение — WikEM
Фон
- Основная причина материнской смертности во всем мире
Причины
Клинические особенности
- Потеря ≥1000 мл крови в первые 24 часа и до 12 недель послеродового периода с естественными родами или кесаревым сечением или кровотечением, связанным с признаками / симптомами гиповолемии в течение 24 часов после рождения [1]
- Однако ≥500 мл кровопотеря после родов через естественные родовые пути является ненормальной и требует дальнейшего исследования
- Обычно в течение 24 часов с момента доставки
- Если происходит более чем через 24 часа после родов, следует учитывать: задержку ВОС, коагулопатию и т. Д.
- Другие подходящие определения [2] :
- Любая потеря крови с нарушением гемодинамической стабильности
Дифференциальный диагноз
3-й триместр / неотложная помощь в послеродовом периоде
Оценка
Обследование
Оценка
Менеджмент
Лечить первопричину: T one, T rauma, T проблема, T хромбоз
- Рассмотреть жидкостную реанимацию по сравнению с продуктами крови при гемодинамической нестабильности
- Ранняя транексамовая кислота (ТХА) снижает смертность из-за кровотечения [3] [4]
- Дайте как можно скорее относительно начала кровотечения
- 1 г ТХА внутривенно в течение 10 минут, со второй дозой через 30 минут, если продолжающееся кровотечение ИЛИ кровотечение возобновляется в течение 24 часов после первой дозы [5]
- Нет разницы между плацебо и ТХА по побочным эффектам, включая тромбоэмболию
- Общая смертность и гистерэктомия, не сниженная с помощью TXA
Тон
Атония матки (мокнущая матка)
- Бимануальный массаж
- Окситоцин (Питоцин)
- 1-я линия и наиболее важный препарат — Окситоцин 80 единиц в пакете NS объемом 500 куб. См , разверните его настежь [6]
- OR 20 МИЛЛИ единиц / мин внутривенно после родов (быстрое введение может вызвать гипотензию)
- OR 10 шт. IM, если нет IV
- Мизопростол (Cytotec) 600 мкг SL или 1000 мкг ректально
- Метилергоновин (Метергин) 0.2 мг внутримышечно каждые 2-4 часа (относительное противопоказание для пациентов с артериальной гипертензией или преэклампсией — может применяться при крайне нестабильном АД)
- Карбопрост (гемабат) 250 мкг внутримышечно каждые 15 мин (избегать у пациентов с астмой)
- Размещение баллона Бакри, заполнить теплым 500 мл NS (или большими / множественными баллончиками или упаковкой) — используйте УЗИ для размещения на верхней части глазного дна и убедитесь, что плацента не задерживается
Травма
Разрыв половых путей
- Проверить на слезы при хорошем освещении и отсосе
- Разрывы шовного материала — восьмерка с рассасывающимся материалом 3-0 или 2-0
- Для глубоких разрывов, например, шейки матки, может потребоваться ИЛИ
- Дренажные гематомы> 3 см
Ткань
Остаточная ткань плаценты
- Оценить задержку продуктов в плаценте
- Тазовый осмотр может быть нормальным, кроме крови
- Обнаружение с US
- Снятие вручную
- Кюретаж
Тромбин
Обратить любые коагулопатии
- Лаборатории — тромбоциты, коаги, фибриноген, d-димер
- Заменить соответствующие компоненты крови
Выворот матки
- Заменить плаценту вручную ИЛИ не удалять плаценту до замены матки:
- Поместите руку во влагалище и протолкните дно к головке вдоль длинной оси влагалища
- Своевременная замена важна, так как шейка матки со временем сжимается, образуя сужающееся кольцо
- Прекратите прием утеротоников (окситоцин), если матка не уменьшена, и рассмотрите варианты миорелаксантов: [7] :
- После замены:
- Массаж дна ± бимануальный массаж / компрессионный
- Затем инфузия окситоцина 40 единиц в 1 л НП при 200-1000 см3 / час
Расположение
См. Также
Вагинальное кровотечение (основное)
Внешние ссылки
Список литературы
- ↑ https: // www.acog.org/clinical/clinical-guidance/practice-bulletin/articles/2017/10/postpartum-hemorrhage
- ↑ WOMAN Trial Collaborators. Влияние раннего введения транексамовой кислоты на смертность, гистерэктомию и другие заболевания у женщин с послеродовым кровотечением (ЖЕНЩИНЫ): международное рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет. 2017 26 апреля. Pii: S0140-6736 (17) 30638-4.
- ↑ Ducloy-Bouthors AS et al. Транексамовая кислота в высоких дозах снижает кровопотерю при послеродовом кровотечении.Crit Care. 2011; 15 (2): R117.
- ↑ WOMAN Trial Collaborators. Влияние раннего введения транексамовой кислоты на смертность, гистерэктомию и другие заболевания у женщин с послеродовым кровотечением (ЖЕНЩИНЫ): международное рандомизированное двойное слепое плацебо-контролируемое исследование. Ланцет. 2017 26 апреля. Pii: S0140-6736 (17) 30638-4.
- ↑ Shakur H et al. WOMAN Trial (Всемирное исследование материнских антифибринолитиков): транексамовая кислота для лечения послеродового кровотечения: международное рандомизированное двойное слепое плацебо-контролируемое исследование.Испытания. 2010 16 апреля; 11:40.
- ↑ Tita AT et al. Высокие дозы окситоцина и кровотечение после естественных родов: рандомизированное контролируемое исследование. Obstet Gynecol. 2012 февраль; 119 (2 пациента 1): 293-300.
- ↑ Неотложная медицина Розена — Концепции и клиническая практика. 8-е изд. 2013. Глава 181: Роды и родоразрешение и их осложнения. 2349.
Видео
ИЗДАТЕЛЬСТВО CSIRO | Размножение, фертильность и развитие
Список литературы
Араки, И., Ду, С., Кобаяси, Х., Савада, Н., Мочизуки, Т., Закодзи, Х., и Такеда, М. (2008, ). Роль механочувствительных ионных каналов в сенсорной трансдукции мочевого пузыря и гиперактивном мочевом пузыре. Внутр. J. Urol. 15 , 681–687.| Роль механочувствительных ионных каналов в сенсорной трансдукции мочевого пузыря и гиперактивности мочевого пузыря. Crossref | GoogleScholarGoogle Scholar | 18462357PubMed | Бэррон, К., Мандала, М., и Осол, Г. (2010, ). Влияние беременности, гипертонии и ингибирования оксида азота на миогенную реактивность маточной артерии крыс. J. Vasc. Res. 47 , 463–471.
| Влияние беременности, гипертонии и ингибирования оксида азота на миогенную реактивность маточной артерии крыс. GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BC3cXht12ksLjO & md5 = 421c6f835dba186ab2b7af06ea172040CAS | 20431295PubMed | Беккер, Б. Н., Ясуда, Т., Кондо, С., Вайкунт, С., Хомма, Т., и Харрис, Р. К. (1998, ). Механическое растяжение / расслабление стимулирует клеточную ренин-ангиотензиновую систему в культивируемых мезангиальных клетках крыс. Exp. Нефрол. 6 , 57–66.
| Механическое растяжение / расслабление стимулирует клеточную ренин-ангиотензиновую систему в культивируемых мезангиальных клетках крыс. GoogleScholarGoogle Scholar | 1: CAS: 528: DyaK1cXhtF2nu7o% 3D & md5 = 6219502632ec0390ca7150c83193e247CAS | 9523174PubMed | Брин, Э.С. (2000, ). Механическая деформация увеличивает экспрессию коллагена I типа в легочных фибробластах in vitro . J. Appl. Physiol. 88 , 203–209.
| 1: CAS: 528: DC% 2BD3cXhtlGgtbw% 3D & md5 = fa
| 1: CAS: 528: DC% 2BD1MXjtFGrt7o% 3D & md5 = aa60b880ab7f84de3e1c6c3debb130c0CAS | Селия Г. и Осол Г.(2002 ). Веноартериальная коммуникация как механизм локальной передачи сигналов в кровообращении матки крыс. Am. J. Obstet. Гинеколь. 187 , 1653–1659.
| Веноартериальная коммуникация как механизм локальной передачи сигналов в маточном кровотоке крысы.Crossref | GoogleScholarGoogle Scholar | 12501079PubMed | Фуллер Р., Бэррон К., Мандала М., Гокина Н. и Осол Г. (2009 ). Преобладание местных факторов над системными в ремоделировании маточных артерий во время беременности. Репродукция. Sci. 16 , 489–500.
| Преобладание местных факторов над системными в ремоделировании маточных артерий во время беременности. Crossref | GoogleScholarGoogle Scholar | 179PubMed | Фуллер Р., Колтон И., Гокина Н., Мандала М. и Осол Г. (2011, ). Локальное и системное влияние на реактивность маточных сосудов во время беременности у однорогих беременных крыс. Репродукция. Sci. 18 , 723–729.
| Локальное и системное влияние на реактивность маточных сосудов во время беременности у однорогих беременных крыс.Crossref | GoogleScholarGoogle Scholar | 21285448PubMed | Гао, Ф., Ляо, Д., Древес, А. М., и Грегерсен, Х. (2009 ). Моделирование вклада эластина, коллагена и гладких мышц в механическое поведение двенадцатиперстной кишки у пациентов с системным склерозом. Нейрогастроэнтерол. Мотил. 21 , 914 – e68.
| Моделирование вклада эластина, коллагена и гладких мышц в механическое поведение двенадцатиперстной кишки у пациентов с системным склерозом. Crossref | GoogleScholarGoogle Scholar | 1: STN: 280: DC% 2BD1Mrmt1Cjtw% 3D% 3D & md5 = 880c953f4971b3db1627c0282fe59f74CAS | 19413680PubMed | Гокина, Н.И., Кузина, О.Ю., Фуллер, Р., Осол, Г. (2009, ). Локальные маточно-плацентарные влияния ответственны за индукцию миогенного тонуса маточной артерии во время беременности крысы. Репродукция. Sci. 16 , 1072–1081.
| Локальные маточно-плацентарные влияния ответственны за индукцию миогенного тонуса маточной артерии во время беременности крыс. GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BD1MXhtlygtLjE & md5 = 6f4ce2cbaaf7894f42b2259aeff4037fCAS | 19657140PubMed | Гриндлинг, К.К., Фуллер, Э. О., Кокс, Р. Х. (1985, ). Изменения маточных и сонных артерий овец при беременности. Am. J. Physiol. 248 , 658–665. Хейл, С.А., Вегер, Л., Мандала, М., и Осол, Г. (2011, ). Снижение передачи сигналов NO во время беременности ослабляет ремоделирование наружной маточной артерии за счет изменения экспрессии ММП и отложения коллагена и эластина. Am. J. Physiol. Heart Circ. Physiol. 301 , h2266 – h2275.
| Снижение передачи сигналов NO во время беременности ослабляет ремоделирование наружной маточной артерии за счет изменения экспрессии ММП и отложения коллагена и эластина.Crossref | GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BC3MXhtlersbfL & md5 = 0a40fe16e6cf0683df1cbc5378dd04f3CAS | 21856919PubMed | Халперн В., Осол Г. и Кой Г. С. (1984, ). Механическое поведение находящихся под давлением преартериолярных сосудов in vitro определено с помощью видеосистемы. Ann. Биомед. Англ. 12 , 463–479.
| Механическое поведение находящихся под давлением преартериолярных сосудов in vitro определено с помощью видеосистемы.Crossref | GoogleScholarGoogle Scholar | 1: STN: 280: DyaL2M7pslShug% 3D% 3D & md5 = 48afbd0b26b75c79b6aabbe491e4f885CAS | 6534218PubMed | Ингбер, Д.E. (2006 ). Клеточная механотрансдукция: снова собираем все вместе. FASEB J. 20 , 811–827.
| Клеточная механотрансдукция: снова собираем все вместе.Crossref | GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BD28XksVegtrY% 3D & md5 = 6ab8309fbaeed99d71ec69810010cd2eCAS | 16675838PubMed | Лай, С. Дж., Митчелл, Дж., Нашман, Н., Ольденхоф, А., Оу, Р., Шинлова, О., и Лангиль, Л. (2001, ). Роль механических сигналов в наступлении срочных и преждевременных родов. Фронт. Horm. Res. 27 , 165–178.
| Роль механических сигналов в наступлении срочных и преждевременных родов. GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BD3MXmtFyqtbc% 3D & md5 = 963b157ea271c114b4e9dac0c8170d56CAS | 11450425PubMed | Моравиц, Х., Ма, Й. Х., Вивес, Ф., Уилсон, Э., Сухатме, В. П., Хольц, Дж., И Айвс, Х. Э. (1999, ). Быстрая индукция и транслокация Egr-1 в ответ на механическое напряжение в гладкомышечных клетках сосудов. Circ.Res. 84 , 678–687.
| 1: CAS: 528: DyaK1MXit1Ois7c% 3D & md5 = dd17522a6570966e87b575726ac82402CAS | 10189355PubMed | Осол, Г. (1995 ). Механотрансдукция гладкими мышцами сосудов. J. Vasc. Res. 32 , 275–292.
| 1: STN: 280: DyaK28% 2FmtFyrsg% 3D% 3D & md5 = 004cbc26e123516f9c2ad2874b19a65eCAS | 7578796PubMed | Осол Г. и Чиполла М. (1993, ). Вызванные беременностью изменения трехмерных механических свойств маточно-плацентарных (лучевых) артерий крыс под давлением. Am. J. Obstet. Гинеколь. 168 , 268–274.
| 1: STN: 280: DyaK3s7ivVequg% 3D% 3D & md5 = adf9a050f72e14f16e4618ca96982573CAS | 8420338PubMed | Осол Г. и Мандала М. (2009 ). Ремоделирование сосудов матки у матери во время беременности. Physiology (Bethesda) 24 , 58–71.
| Ремоделирование сосудов матки у матери во время беременности. GoogleScholarGoogle Scholar | Осол Г., Бэррон К., Гокина Н. и Мандала М.(2009 ). Ингибирование синтаз оксида азота отменяет вызванное беременностью расширяющееся ремоделирование сосудов матки. J. Vasc. Res. 46 , 478–486.
| Ингибирование синтаз оксида азота отменяет вызванное беременностью расширяющееся ремоделирование сосудов матки.Crossref | GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BD1MXpvFCks7s% 3D & md5 = c334d07cf6a3697ab84b3904cefa1026CAS | 105PubMed | Оу, К. В., Орсино, А., и Лай, С. Дж. (1997, ). Экспрессия коннексина-43 и коннексина-26 в миометрии крыс во время беременности и родов по-разному регулируется механическими и гормональными сигналами. Эндокринология 138 , 5398–5407.
| Экспрессия коннексина-43 и коннексина-26 в миометрии крыс во время беременности и родов по-разному регулируется механическими и гормональными сигналами.Crossref | GoogleScholarGoogle Scholar | 1: CAS: 528: DyaK2sXnsFOqsbY% 3D & md5 = a41362e17fd386b0aa3e715fd1286bf6CAS | 9389525PubMed | Пейдж К. Л., Селия Г., Ледди Г., Таатжес Д. Дж. И Осол Г. (2002, ). Структурное ремоделирование маточных вен крыс при беременности. Am. J. Obstet. Гинеколь. 187 , 1647–1652.
| Структурное ремоделирование маточных вен крыс во время беременности. GoogleScholarGoogle Scholar | 12501078PubMed | Пик, М. А., Куллинг, Л. М., Магней, Дж. Л., Томас, П. Б. и Эль-Хадж, А. Дж. (2000, ). Выбранный вклад: регуляторные пути, участвующие в механической индукции экспрессии гена c-fos в костных клетках. J. Appl. Physiol. 89 , 2498–2507.
| 1: CAS: 528: DC% 2BD3MXhtFOisg% 3D% 3D & md5 = d03f8130f9a6459ac15392eb7b9ae06fCAS | 110
| Реконструкция сосудов матки, вызванная беременностью. GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BC3cXhvVKgt7g% 3D & md5 = 29b4be5b7d50502b282c8fd825af690dCAS | 19495699PubMed | Шинлова, О. П., Ольденхоф, А. Д., Лю, М., Лангиль, Л., и Лай, С. Дж. (2002, ). Регулирование экспрессии c-fos статическим растяжением в гладкомышечных клетках миометрия крысы. Am. J. Obstet. Гинеколь. 186 , 1358–1365.
| Регулирование экспрессии c-fos статическим растяжением в гладкомышечных клетках миометрия крысы. GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BD38XlsFyjsrg% 3D & md5 = 65d63311c3b3e94ac67d64ccceba0f45CAS | 12066122PubMed | Шинлова, О., Митчелл, Дж. А., Цампальерос, А., Лангиль, Б. Л., и Лай, С. Дж. (2004, ). Прогестерон и беременность по-разному регулируют экспрессию компонентов внеклеточного матрикса в миометрии беременных крыс. Biol. Репрод. 70 , 986–992.
| Прогестерон и беременность по-разному регулируют экспрессию компонентов внеклеточного матрикса в миометрии беременных крыс. GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BD2cXis1Siurw% 3D & md5 = f0c8400f6dfa7e2a18f795737f8cb9dbCAS | 14645109PubMed | Шинлова О., Цуй П., Джаффер С. и Лай С. Дж. (2009, ). Интеграция эндокринных и механических сигналов в регуляции функций миометрия во время беременности и родов. Eur. J. Obstet. Гинеколь. Репрод. Биол. 144 , S2 – S10.
| Интеграция эндокринных и механических сигналов в регуляции функций миометрия во время беременности и родов. GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BD1MXksVWmsrs% 3D & md5 = dfe8a92d9f6562c87807b08a5e0c9c91CAS | 164PubMed | Смит, Т. К., Спенсер, Н. Дж., Хенниг, Г. У. и Диксон, Э. Дж. (2007, ). Последние достижения кишечной нейробиологии: механочувствительные интернейроны. Нейрогастроэнтерол. Мотил. 19 , 869–878.
| Последние достижения кишечной нейробиологии: механочувствительные интернейроны.Crossref | GoogleScholarGoogle Scholar | 1: STN: 280: DC% 2BD2snmsVWntQ% 3D% 3D & md5 = ac31c52fca465ad891e71f5d3b05c2acCAS | 17988274PubMed | Спраг, Б. Дж., Фернеттон, Т. М., Магнесс, Р. Р. и Чеслер, Н. К. (2009, ). Влияние овариального цикла и беременности на импеданс сосудов матки и механику маточных артерий. Eur. Дж.Акушерство. Гинеколь. Репрод. Биол. 144 , S170 – S178.
| Влияние овариального цикла и беременности на сопротивление сосудов матки и механику маточных артерий.Crossref | GoogleScholarGoogle Scholar | 1
74PubMed |
ван дер Хейден, О. В., Эссерс, Ю. П., Фацци, Г., Петерс, Л. Л., Де Мей, Дж. Г. и ван Эйс, Г. Дж. (2005, ). Ремоделирование маточной артерии и репродуктивная способность нарушены у мышей с дефицитом синтазы оксида азота эндотелия. Biol.Репрод. 72 , 1161–1168.
| Ремоделирование маточной артерии и репродуктивная способность нарушены у мышей с дефицитом синтазы оксида азота эндотелия.Crossref | GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BD2MXjslSntro% 3D & md5 = 1a84298be37f1afc09bf982555f234d4CAS | 15659709PubMed |
Ван, Дж. Х. и Темпатти, Б. П. (2006 ). Вводный обзор клеточной механобиологии. Biomech. Модель. Механобиол. 5 , 1–16.
| Вводный обзор клеточной механобиологии.Crossref | GoogleScholarGoogle Scholar | 1: CAS: 528: DC% 2BD28XhvFCru7c% 3D & md5 = 2b0ce8e0eec013e057242708c764e478CAS | 16489478PubMed |
Вэй, Б.


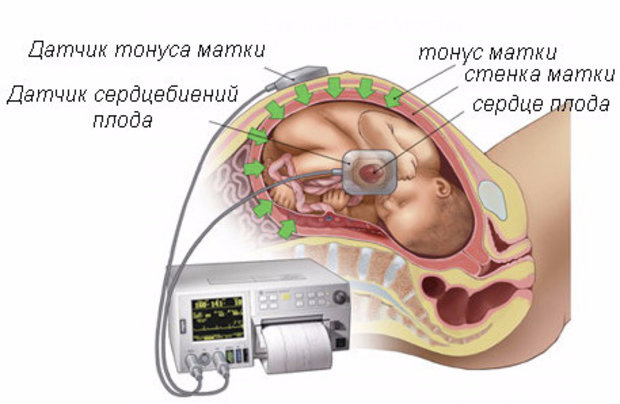 Попробуй поскользнуться
перед шейкой матки и нащупайте плод или семядоли / карункулы.
Попробуй поскользнуться
перед шейкой матки и нащупайте плод или семядоли / карункулы.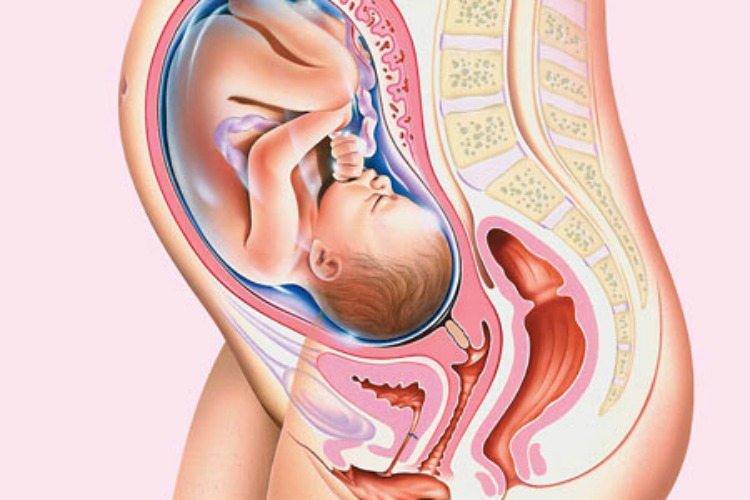
 Вы должны исключить, что вы не пальпируете
яичник на ощупь не менее 3.
Вы должны исключить, что вы не пальпируете
яичник на ощупь не менее 3. 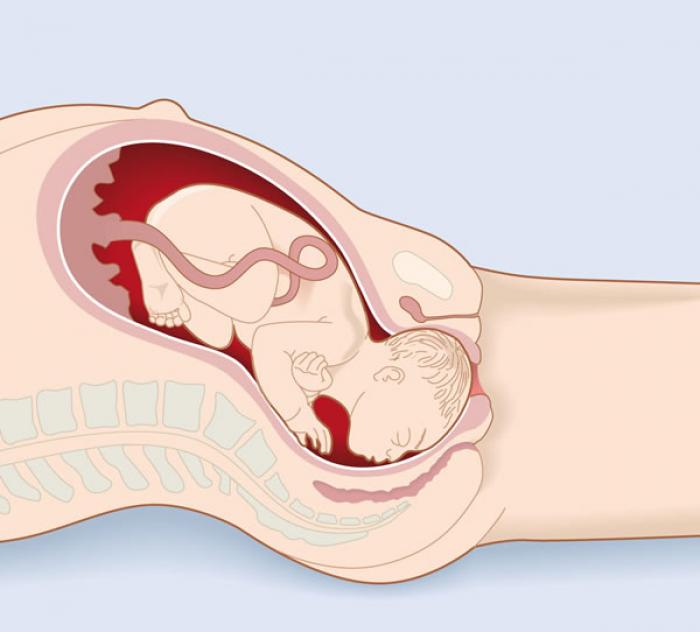




 , 1988) или 12 дней (Pierson
и Гинтер, 1984) в период беременности.
, 1988) или 12 дней (Pierson
и Гинтер, 1984) в период беременности. Субъективная оценка
анатомических признаков могут быть использованы для старения плодов крупного рогатого скота,
Субъективная оценка
анатомических признаков могут быть использованы для старения плодов крупного рогатого скота, 
 беременная.
беременная.
 Было ли это коровы, которые проверяли
сказали, что были беременны или были ложные срабатывания и отрицательные результаты.
Было ли это коровы, которые проверяли
сказали, что были беременны или были ложные срабатывания и отрицательные результаты. Поскольку вам нужен RIA, будет задержка по времени
между образцами и результатами. Кроме того, вы не можете определить возраст, пол или
жизнеспособность плода. Излишне говорить, что это
техника не используется никем из известных мне.
Поскольку вам нужен RIA, будет задержка по времени
между образцами и результатами. Кроме того, вы не можете определить возраст, пол или
жизнеспособность плода. Излишне говорить, что это
техника не используется никем из известных мне. небеременные коровы на момент отбора проб — требуется
двукратная обработка коров
небеременные коровы на момент отбора проб — требуется
двукратная обработка коров Оценка коммерчески доступного фактора раннего зачатия (ECF)
тест для определения стельности молочного скота. J Dairy Sci.
84: 1884-9, 2001.
Оценка коммерчески доступного фактора раннего зачатия (ECF)
тест для определения стельности молочного скота. J Dairy Sci.
84: 1884-9, 2001.